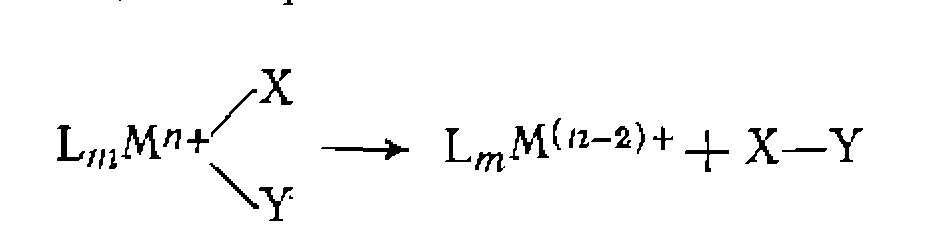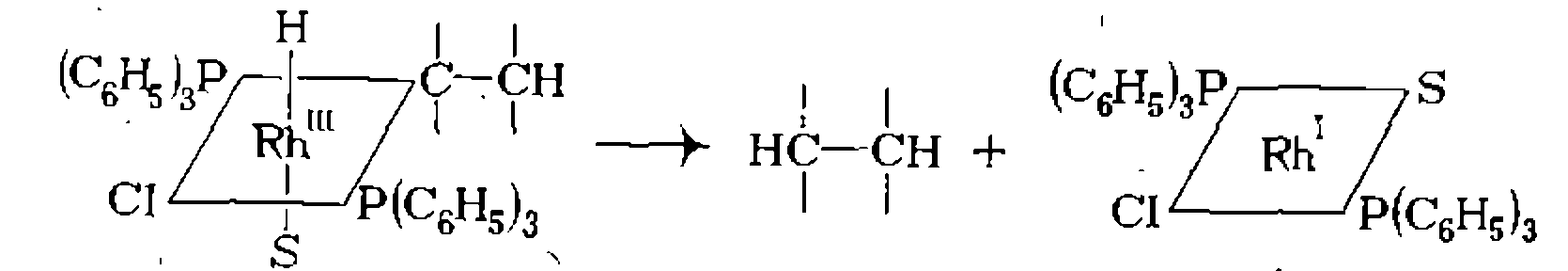|
|
КОМПЛЕКСЫ ПЕРЕХОДНЫХ МЕТАЛЛОВ В КАТАЛИЗЕ ОРГАНИЧЕСКИХ РЕАКЦИЙКатализ органических реакций комплексами металлов является в настоящее время наиболее интенсивно и продуктивно развивающейся областью гомогенного катализа. Повышенный интерес к металлокомплексным катализаторам .связан с высокой скоростью и селективностью вызываемых ими превращений," а также возможностью осуществлять новые реакции, трудно реализуемые другими методами. Каталитические свойства комплексов переходных металлов обеспечиваются наличием близких по энергиям трех свободных лр- и частично заполненных одной ns- и пяти (п—1) d-орбиталей. Эти девять валентных орбиталей могут участвовать в образовании связей практически с каждым элементом .Периодической системы, что обеспечивает огромное многообразие лигандов в комплексах переходных металлов, в числе которых находится подавляющее большинство опганических молркул и их потенциальных реагентов
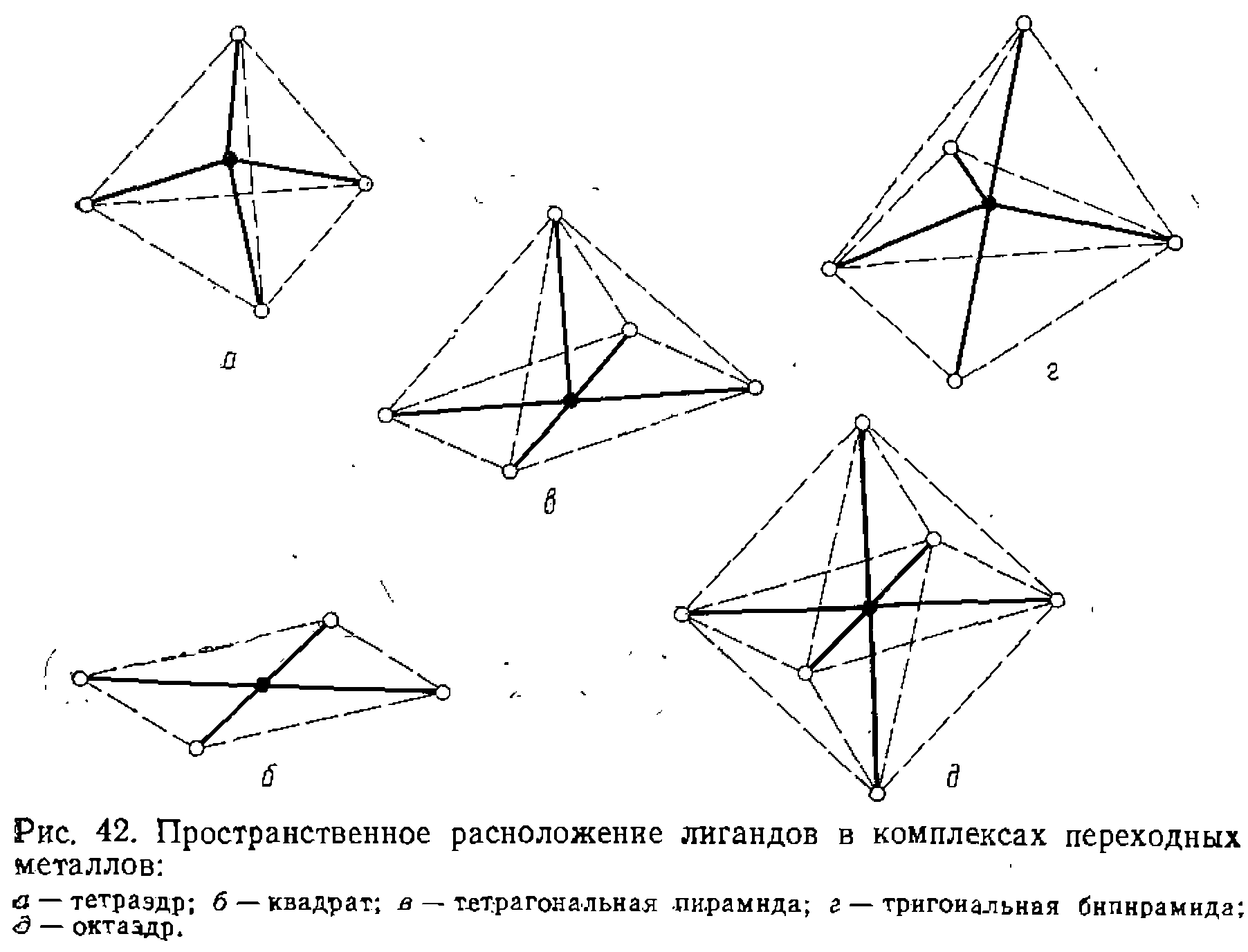
Однако наиболее распространенные координационные числа в комплексах металлов, катализирующих органические реакции,— 4, 5 и 6. Этим числам отвечают пять способов пространственного расположения лигандов, которые определяются направлением гибридизованных орбиталей, участвующих в образовании ст-связей (рис. 42 и табл. 14). Гибридизованные орбитали, образующие cr-связи в комплексе, заняты, как правило, электронами лигандов. Оставшиеся ,d-орбитали участвуют в образовании л;-связей с лигандами или заняты свободными парами электронов. При этом общее число электронов в валентной оболочке комплекса металла, как правило, составляет 16 или 18. При образовании связей металла с лигандами изменяется фактический заряд на атоме или ионе металла: заряд возрастает при образовании связи за счет пары
электронов металла или снижается при участии в связывании пары электронов лиганда. Поскольку результирующее измене- ние заряда может быть разным и зависит от природы лиганда, для унификации понятия «степень окисления металла» условно считают, что каждый лиганд связан только одной icr-связью с металлом за счет пары электронов, принадлежащей лиганду. Заряд, оставшийся при таком условном рассмотрении на металле, представляет собой степень окисления металла. По типу связывания с металлом лиганды классифицируют как
1.
2. участвующими в образовании связи с металлом
образуют jt-связь, схематически изображенную на рис. 44.
3.
Пример такой связи металла с молекулой СО приведен на рис. 45. Связывание с-лигандов дополнительными я-связями с металлом— одна из причин образования прочных связей между «мягкими» кислотами .Льюиса и «мягкими» основаниями. Другой важной особенностью этих связей является существенное изменение распределения электронов в лиганде, что приводит в ряде случаев к его активированию и последующим химическим превращениям. Так, нагнетание
связи в ским превращениям, аналогичным реакциям карбонильной группы С=О. Экспериментальным подтверждением этого служит сравнение колебательных спектров свободной и координированной молекул СО. Если свободная молекула имеет
В отличие от рассмотренных На рис. 46 показаны орбитали, участвующие в образовании связи олефина с металлом. Реакции, катализируемые комплексами металлов, представляют собой последовательность элементарных стадий, включающих ввод реагента (или реагентов) в координационную сферу металла, превращение координированных молекул и регенера- цию исходной формы каталитического комплекса. Эти стадии более многочисленны и разнообразны по сравнению с рассмотренными выше реакциями, протекающими при нуклеофильном, электрофильном и кислотно-основном катализе. Поэтому расшифровка механизма металлокомплексного катализа является обычно более сложной задачей. Правильному построению последовательности элементарных стадий реакции, катализируемой диамагнитным комплексом металла, способствует применение правила 16 или 18 электронов, сформулированного Толмаиом. Согласно этому правилу, диамагнитные комплексы переходных металлов существуют в кинетически или спектроскопически определяемых концентрациях только в том случае, если число валентных электронов в координационной сфере металла равно 16 или 18. Под валентными электронами понимают при этом валентные электроны металла в соответствующей степени окисления плюс пары электронов лигандов, вносимые ими при образовании координационных связей. Из этого правила следует, что все превращения комплекса металла в ходе реакции происходят через образование промежуточных частиц, имеющих только 16 и 18 валентных электронов у металла, а изменение числа валентных электронов на каждой стадии не превышает двух (0, +2 или —2). Рассмотрим подробнее основные типы реакций комплексных соединений, представляющие собой отдельные стадии металлокомплексного катализа. А. Диссоциация, присоединение и замещение лигандов. Введение молекулы реагента в координационную сферу комплекса происходит по реакции присоединения при наличии свободного координационного места (при координационной ненасыщенно- сти) или в результате замещения одного из лигандов. Координационно ненасыщенные 16-электронные комплексы могут образоваться в результате термического или фотохимического отщепления одного из лигандов. Например, 18-электронный комплекс пентакарбонила железа
Этот комплекс способен присоединить на свободное координационное место молекулу субстрата и является каталитически активной частицей в реакциях гидрирования. В известных стабильных координационно ненасыщенных 16-электронных комплексах, например. в квадратных, лексах
свободное ко ординационное место обычно занято слабо связанной молекулой растворителя. Для таких комплексов первая стадия каталитиче- ского цикла — замещение молекулы растворителя 5 субстратом У:
Молекупа субстрата может входить в координационную сферу и координационно насыщенного 18-электронного комплекса, замещая более прочно связанные с металлом лнганды:
Существуют два граничных типа механизмов этой реакции. Пер вый
или диссоциативный) включает предварительную мед ленную диссоциацию комплекса н последующее быстрое присоединение субстрата на свободное координационное место:
Скорость этой реакции описывается кинетическим уравнением первого пооядка:
При -механизме (ассоциативный механизм) 'разрыв, старой и образование новой связи с лигандом происходят синхронно
и скорость реакции описывается кинетическим уравнением второго порядка:
В ряде случаев в реакции участвует молекула растворителя, ипроцесс замещения происходит по двум последовательным Скорость процесса описывается кинетическим уравнением первого порядка, и схема его кинетически не отличается от уравнения (111-43). Замещение с участием растворителя иногда конкурирует с прямым
Природа лиганда L в рассмотренных реакциях существенно влияет на скорость замещения X. Характер влияния может быть электронным и стерическим. Более объемистые лиганды обычно способствуют диссоциации комплекса. Электронные эффекты наиболее сильно проявляются у лиганда, расположенного в траяс-положении .по отношению к замещаемому (так называемый траяс-эффект). Это связано с участием одной орбитали металла в образовании связи с двумя лигандами, находящимися в траяс-положении друг к другу. По способности облегчать замещение в траяс-положении лигаиды располагаются в единый ряд, который приблизительно соответствует возрастанию «мягкости» основания и прочности его связи с металлом:
Различие скоростей замещения траяс-лигандов в этом ряду может быть весьма значительным. Например, скорость реакции
при Б. Перенос электрона. Реакции переноса электрона происходят между двумя комплексами или между комплексом металла и органической молекулой. В последнем случае изменяется степень окисления металла, а органическая молекула претерпевает химическое превращение. Например, одна из стадий окисления алкнлароматических соединений при катализе комплексами Со протекает по схеме: В реакциях между двумя комплексами электрон передается от одного к другому, и степень окисления металла изменяется в обоих комплексах. Эта реакция протекает в некоторых окислительно-восстановительных каталитических процессах и является обычно стадией регенерации катализатора. Различают два механизма этой реакции: внешне- и внутрисферный. При внешне- сферном механизме оба комплекса сохраняют свою координационную оболочку и электрон передается через обе координационные сферы. Например:
При внутрисферном механизме два комплекса образуют промежуточный продукт, в котором один из лигандов—■ общий и служит проводником электрона.
В. Диссоциативная координация молекул X—Y с разрывом О'Связи. Активирование реагента X—Y при его координации с металлом может приводить к полному разрыву одной из связей в его молекуле. При этом образовавшиеся фрагменты X и Y ила один из них оказываются в координационной сфере комплекса и претерпевают дальнейшие превращения. Различают три типа диссоциативного присоединения X—Y к металлу: окислительное, гомолитическое и гетеролитическое. 1. Окислительное присоединение протекает по общей схеме: Этот процесс можно представить как передачу двух электронов металла молекуле X—Y, в результате чего происходит разрыв связи в ней и образование двух лигандов занимают свободные координационные места ъ новом комплексе. В некоторых случаях реакция бывает обратимой (обратный процесс называется восстановительным элиминированием). Окислительное присоединение возможно при существовании высшей степени окисления металла (я+2), при наличии у металла пары несвязывающих электронов и двух свободных координационных мест для входящих лигандов X и Y. Наиболее типично окислительное присоединение для координационно-ненасыщенных 16-электронных квадратных Реакции окислительного присоединения известнытакже для
В реакции окислительного присоединения вступают и координационно-насыщенные 18-электронные комплексы. В этом случае присоединение X и Y сопровождается отрывом одного из лигандов. Такие реакции называют также окислительным замещением:
Различают несколько механизмовокислительного присоединения. Для неполярных реагентов Возможен также стадийный механизм с предварительным гете- ро- или гомолитическим разрывом связи в молекуле X—Y. Для веществ, обладающих кислотными свойствами (Н—X), в полярных средах характерна предварительная ионизация протоиирование комплекса и последующее присоединение Х:~ Гетеролитический разрыв связи в X—Y возможен также при нуклеофильной атаке металлом (как в Реакции окислительного присоединения к некоторым металлам, существующим в промежуточных степенях окисления, протекают па радикальному механизму и ускоряются инициаторами ^радикально-цепных реакций. Такой механизм окислительного присоединения установлен, в частности, для некоторых комплексов
Для всех стадийных механизмов в отлнчие от синхронного ха- .рактерно образование продуктов граяс-присоединения:
В металлокомплексном катализе реакции окислительного присоединения представляют собой одну из стадий широко распространенных реакций гомогенного гидрирования, карбонили- .рования, гидрокарбонилирования. 2. Гомолитическое присоединение -сопровождается увеличением степени окисления металла на единицу и происходит прн 'взаимодействии молекулы X—Y с двумя атомами металла: Лр имером такой реакции является образование каталитически активной частицы в реакции гидрокарбонилирования — из дикобальтоктакарбонила: .Аналогичные реакции с моноядерными комплексами включают, .по-видимому, стадию димеризацин: 3. Гетеролитнческое присоединение происходит без изменения ^степени окисления и координационного числа и представляет собой замещение лиганда, сопровождающееся гетеролитическим ■разрывом связи в X—Y: .Примером такой реакции может служитьобразование каталитически активной частицы из комплекса Эти реакции ускоряются основаниями, связывающими образующийся .Гетеролитичеокое присоединение может являться также результатом последовательно протекающих реакций окислительного присоединения и восстановительного элиминирования. Та кой путь реализуется, в частности, в следующей реакции:
Г. Внедрение по связи металл — лиганд. Реакция внедрения* представляет собой образование химической связи между лигандами X и Y, находящимися в координационной сфере металла. Новый фрагмент X—Y остается связанным с металлом, и конечный результат реакции представляется как внедрение лиганда X по связи М—Y: Эта стадия характерна для большинства реакций ненасыщенных, соединений и СО, катализируемых комплексами металлов. Ее можно представить как внутрисферную нуклеофильную атаку лигандом Y на активированную координацией молекулу X, в роли которой выступает обычно ненасыщенное соединение или СО. Например, одной из стадий реакции окисления этилена до ацет- альдегида является внутрис-ферная нуклеофильная атака гидроксил-ионом на координированную молекулу этилена с образованием нового
Аналогично происходит внедрение этилена по связи металл —алкил нли металл — водород в реакциях олигомеризации и полимеризации олефинов:
Вакантное после присоединения лиганда ционное место занимает молекула растворителя или новый лиганд Y. Наличие в реакционной массе избытка лигандов, легко- координирующихся с металлом, обычно благоприятствует реакции внедрения. В частности, избыток СО ускоряет образование- ацетильной группы в координационной сфере Мл, протекающее по схеме: Образование немеченой карбонильной группы аз зывает внутрисферный механизм взаимодействия Д. Внешняя нуклеофильная или электрофильная атака лиганда. Аналогичные превращения координированных лигандов могут происходить также в результате внешней нуклеофильной атаки: Механизм таких реакций в принципе не отличается от рассмотренного ранее механизма лимитирующей стадии электрофильно- го катализа. Так происходит, в частности, образование продукта гидролиза эфира глицина в традиционно относящейся к элект- рофильному катализу реакции:
К стадиям металлокомплексного катализа принято относить внешнюю нуклеофильную атаку на такие лиганды, как СО, оле- фины, ацетилены, нитрилы, изонитрильг, например: Известны также реакции комплексных соединений, в которых внешняя атака иа лиганд осуществляется электрофильиой частицей. В металлокомплексном катализе это чаще всего реакции протонирования лигандов, приводящие к образованию продукта и выходу его из координационной сферы: Е.
анионы. Необходимое условие протекания этих реакций — наличие у металла свободного координационного места. Отрыв гидрид-иона от и является завершающей стадией в металлокомплексном катализе реакций полимеризации, олигомеризации и изомеризации олефинов. Известны аналогичные реакции, протекающие с отрывом атома водорода от
Ж- Восстановительное элиминирование. Реакция восстановительного элиминирования, как отмечено выше, является обратной по отношению к окислительному присоединению. В процессе восстановительного элиминирования происходит образование Эта реакция обычно завершает химические превращения в координационной сфере и приводит к образованию конечного продукта. В частности, гомогенное гидрирование при катализе комплексами родия заканчивается следующей реакцией восстановительного элиминирования.
13—98 ■ - . - - 1дз 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|


 лиганды.
лиганды. Лиганды имеют одну или несколько неподеленных пар электронов, локализованных при одном донорном атоме. Одна пара электронов
Лиганды имеют одну или несколько неподеленных пар электронов, локализованных при одном донорном атоме. Одна пара электронов  лиганда взаимодействует с вакантной гиб- ридизованной орбиталью металла и образует
лиганда взаимодействует с вакантной гиб- ридизованной орбиталью металла и образует  связь. По типу дополнительного связывания с металлом ст-лиганды подразделяют на три группы.
связь. По типу дополнительного связывания с металлом ст-лиганды подразделяют на три группы. Лиганды, имеющие только одну свободную электроннук> пару и не имеющие доступных вакантных орбиталей ■
Лиганды, имеющие только одну свободную электроннук> пару и не имеющие доступных вакантных орбиталей ■  „
„ . Эти лиганды образуют единственную а-связь, заполняя одну из перечисленных в таблице гибридных орбита- лей металла (рис. 43).
. Эти лиганды образуют единственную а-связь, заполняя одну из перечисленных в таблице гибридных орбита- лей металла (рис. 43). Лиганды с .несколькими свободными парами электронов,.
Лиганды с .несколькими свободными парами электронов,.
 и т. п.)* Эти лиганды кроме ст-связи дополнительно
и т. п.)* Эти лиганды кроме ст-связи дополнительно Связь лиганда с металлом образует одна из заполненных орбиталей лиганда
Связь лиганда с металлом образует одна из заполненных орбиталей лиганда  . Другая свободная пара электронов лиганда, перпендикулярная оси металл — лиганд
. Другая свободная пара электронов лиганда, перпендикулярная оси металл — лиганд  J образует
J образует  связь, не имеющую вращательной симметрии. Такие ст-лиган- ды называют л;-донорными.
связь, не имеющую вращательной симметрии. Такие ст-лиган- ды называют л;-донорными.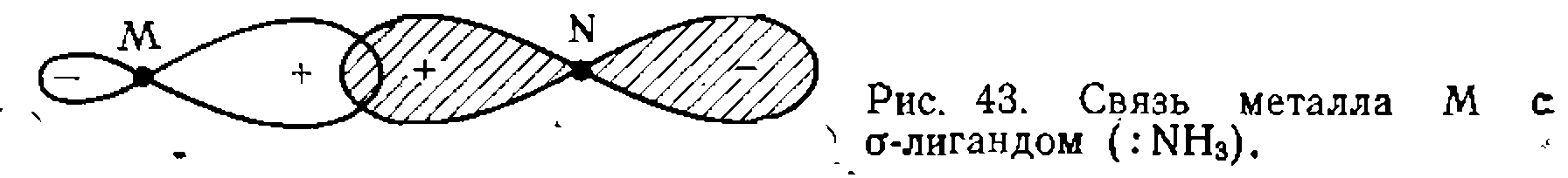
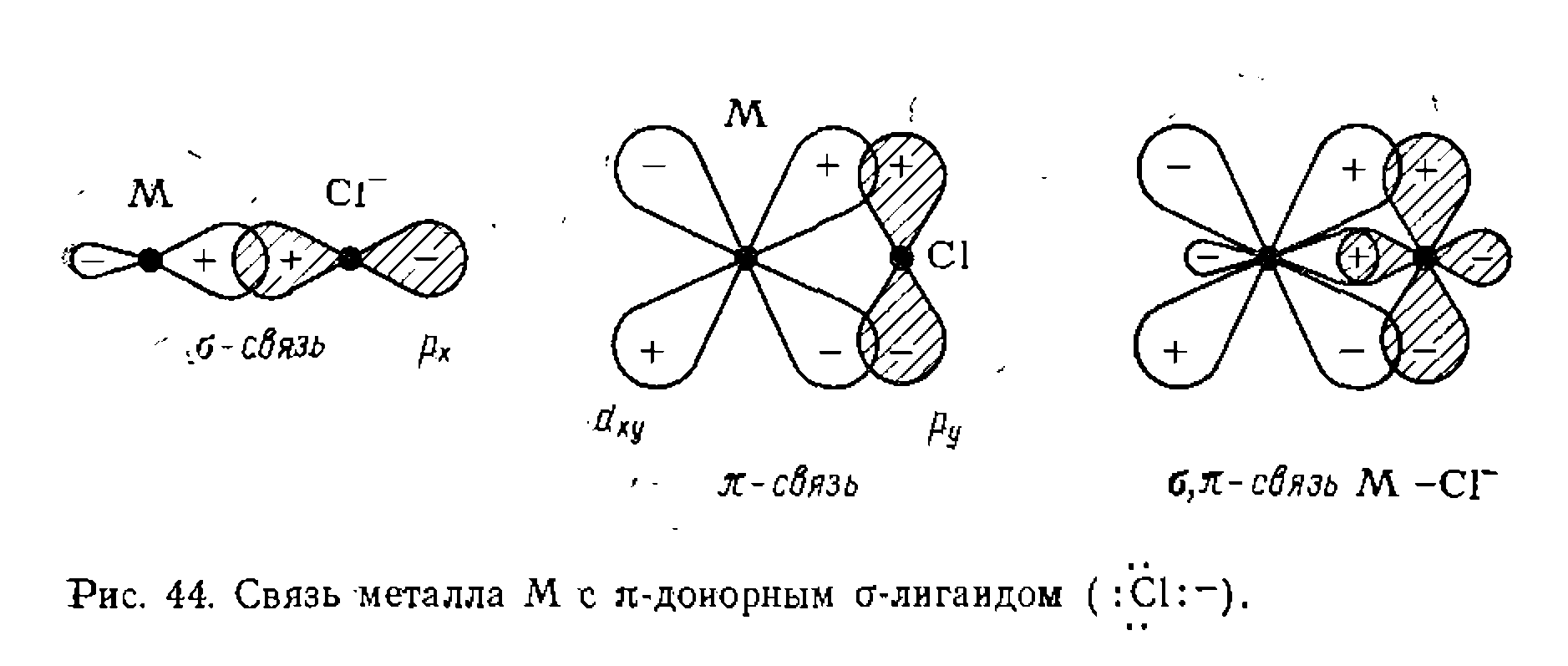
 Лиганды, имеющие в дополнение к свободной паре электронов энергетически доступную вакантную орбиталь
Лиганды, имеющие в дополнение к свободной паре электронов энергетически доступную вакантную орбиталь  ,
, и т. п.). Эти лиганды образуют дополнительную
и т. п.). Эти лиганды образуют дополнительную  связь при взаимодействии свободных пар
связь при взаимодействии свободных пар  электронов металла с .вакантными орбиталями перечисленных
электронов металла с .вакантными орбиталями перечисленных  акцепторных лигандов. Это может'быть свободная
акцепторных лигандов. Это может'быть свободная  орбиталь в карбене
орбиталь в карбене  или в нитрене
или в нитрене  или антисвязывающая (разрыхляющая)
или антисвязывающая (разрыхляющая)  -орбиталь в СО и ,N0. Такой тип
-орбиталь в СО и ,N0. Такой тип  связывания металла с лигандом называют еще дативной связью.
связывания металла с лигандом называют еще дативной связью. Связь СО с металлом образуется в результате взаимодействия одной из свободных гибридныхорбиталей с заполненной
Связь СО с металлом образуется в результате взаимодействия одной из свободных гибридныхорбиталей с заполненной  орбиталью атома углерода в
орбиталью атома углерода в  Дополнительную
Дополнительную  связь образует свободная пара
связь образует свободная пара  электронов металла, взаимодействуя со свободной разрыхляющей
электронов металла, взаимодействуя со свободной разрыхляющей  орбиталью СО (рис. 45). При образовании этой связи в отличие от ранее рассмотренных происходит обратная передача электронов от металла к лиганду.
орбиталью СО (рис. 45). При образовании этой связи в отличие от ранее рассмотренных происходит обратная передача электронов от металла к лиганду. электронов металла на разрыхляющую орбиталь молекулы СО значительно снижает кратность
электронов металла на разрыхляющую орбиталь молекулы СО значительно снижает кратность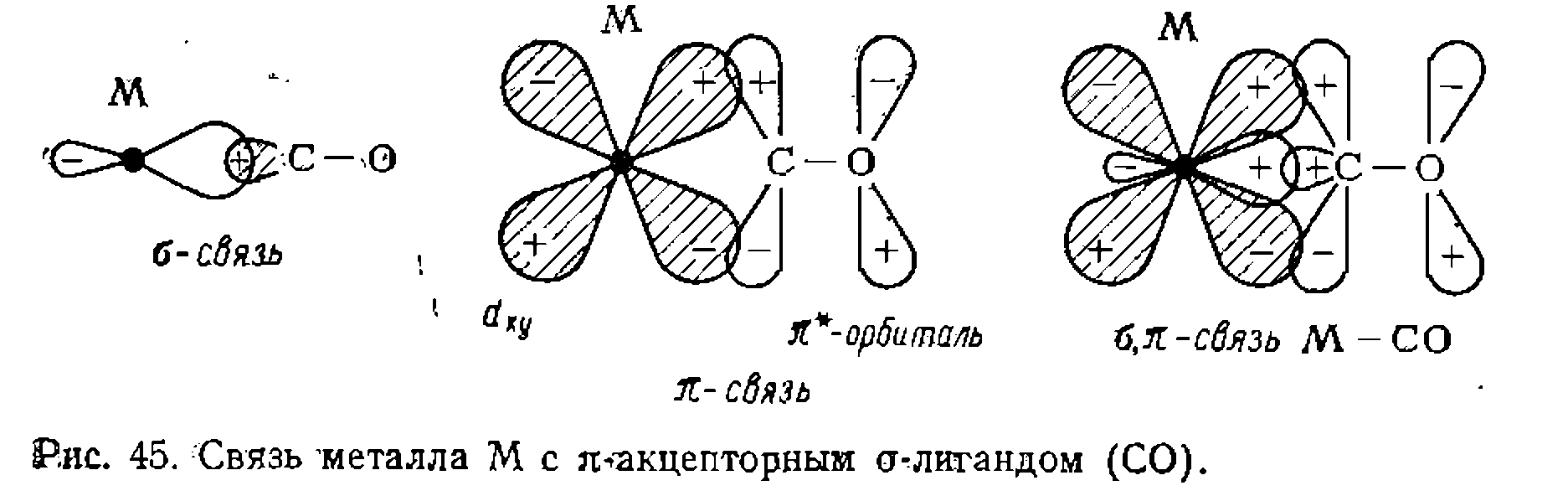

 и, делает оксид углерода способным к химиче
и, делает оксид углерода способным к химиче то молекула СО в карбонилах металлов —
то молекула СО в карбонилах металлов — 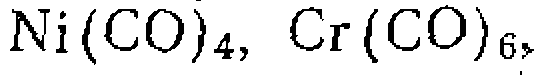
 и т. д. — характеризуется значениями vco = = 1800-^-2100 см-\ которые для некоторых комплексов приближаются к значению полосы поглощения карбонильной группы vco=1770 см'1.
и т. д. — характеризуется значениями vco = = 1800-^-2100 см-\ которые для некоторых комплексов приближаются к значению полосы поглощения карбонильной группы vco=1770 см'1. лигандов
лигандов  лиганды имеют донорные пары электронов, локализованные на двух и более центрах н представляющие собой
лиганды имеют донорные пары электронов, локализованные на двух и более центрах н представляющие собой  электронные пары. Комплексы металлов с
электронные пары. Комплексы металлов с  лигандами называют
лигандами называют  комплексами. К
комплексами. К  лигандам относятся соединения с двойной и тройной углерод-угле- родными связями, производные ароматических соединений, диены. Некоторые лиганды могут выступать в роли и
лигандам относятся соединения с двойной и тройной углерод-угле- родными связями, производные ароматических соединений, диены. Некоторые лиганды могут выступать в роли и  , и
, и  лигандов (СО, N2).
лигандов (СО, N2). Связь с олефином образуется в. результате взаимодействия пары л:-злектронов олефинасо свободной гибридной орбиталью металла. Свободная пара
Связь с олефином образуется в. результате взаимодействия пары л:-злектронов олефинасо свободной гибридной орбиталью металла. Свободная пара  электронов металла участвует в образовании
электронов металла участвует в образовании  связи, взаимодействуя со свободной антисвязывающей
связи, взаимодействуя со свободной антисвязывающей  орбиталью олефина. Оба типа взаимодействия приводят к ослаблению связи С = С и уменьшению ее кратности, что сопровождается, в частности, увеличением длины связи С—С в координированной молекуле олефина. Длина такой связи имеет промежуточное значение между длиной связей С = С (0,134 нм) и С—С (0,154 нм). Аналогично рассмотренной выше координации молекулы СО, молекула олефина- в результате образования как
орбиталью олефина. Оба типа взаимодействия приводят к ослаблению связи С = С и уменьшению ее кратности, что сопровождается, в частности, увеличением длины связи С—С в координированной молекуле олефина. Длина такой связи имеет промежуточное значение между длиной связей С = С (0,134 нм) и С—С (0,154 нм). Аналогично рассмотренной выше координации молекулы СО, молекула олефина- в результате образования как  , так и
, так и  связи с металлом активируется и становится способной к последующему взаимодействию с нуклеофильными частицами и с другими реагентами.
связи с металлом активируется и становится способной к последующему взаимодействию с нуклеофильными частицами и с другими реагентами. .[8 электронов
.[8 электронов  + 10 (2X5) электронов лигандов] путем термической диссоциации при л;160°С образует координационно ненасыщенный 16-электронный комплекс:
+ 10 (2X5) электронов лигандов] путем термической диссоциации при л;160°С образует координационно ненасыщенный 16-электронный комплекс: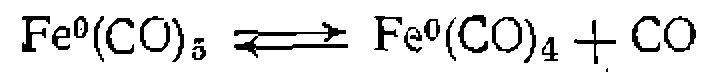
 -комп
-комп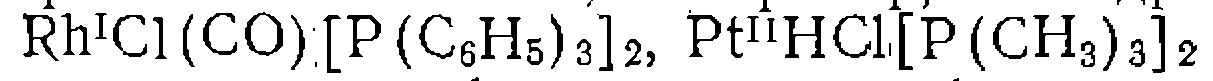
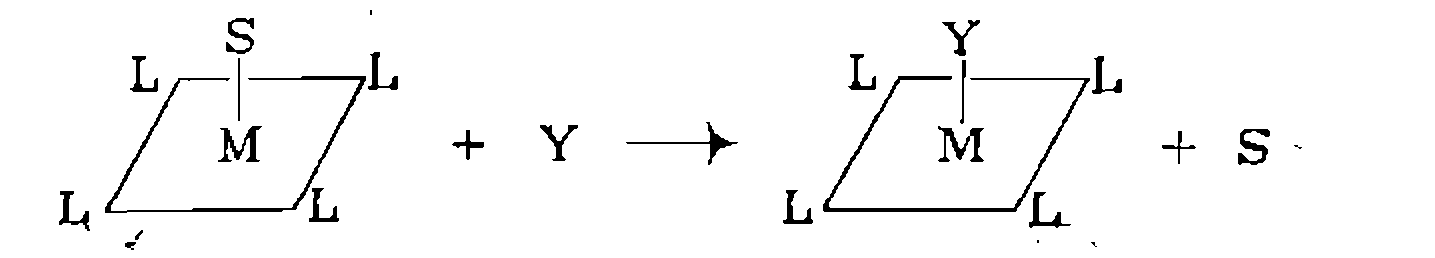

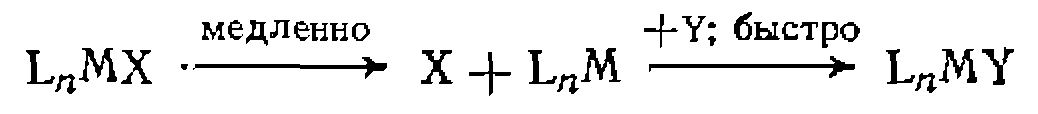

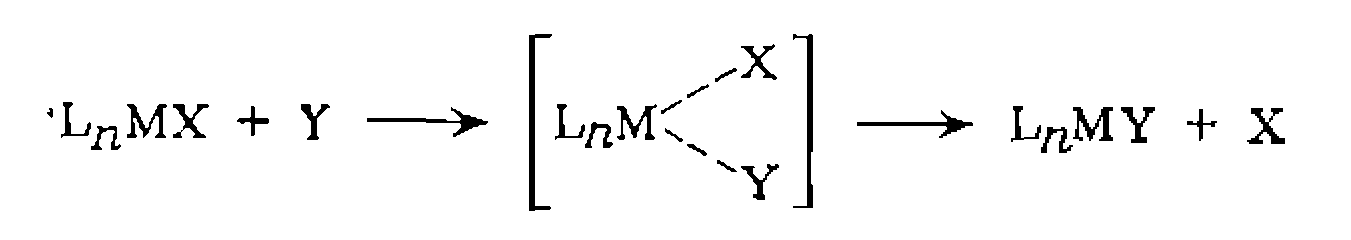
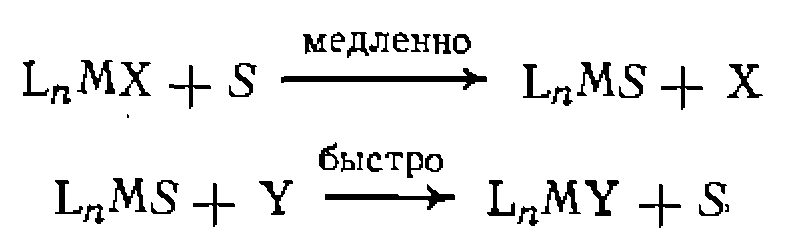

 -реакциям:
-реакциям: -замещением. В этом случае кинетическое уравнение включает два слагаемых:
-замещением. В этом случае кинетическое уравнение включает два слагаемых: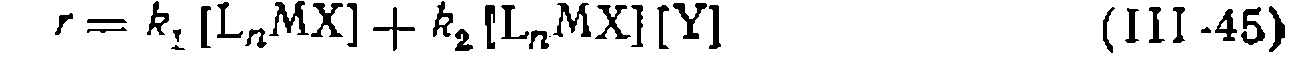
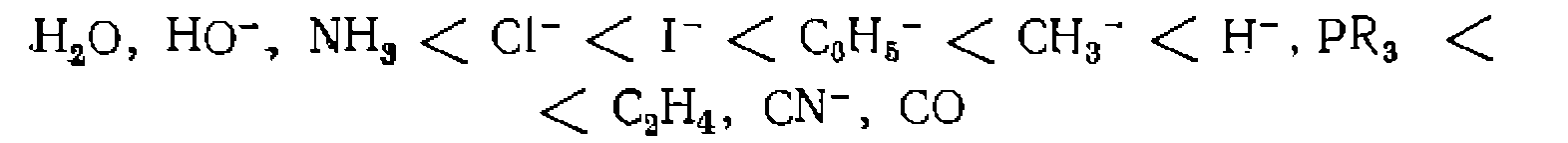
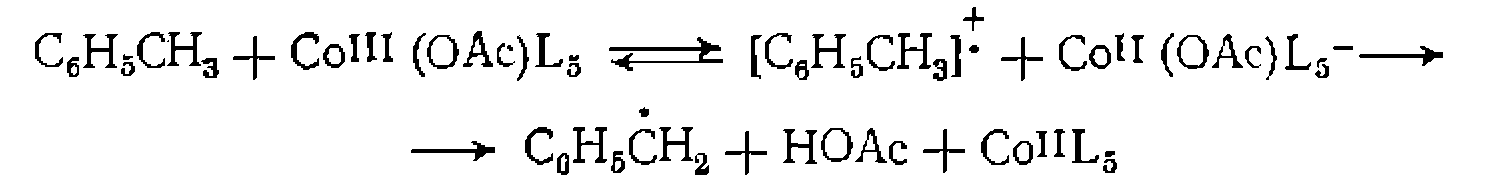
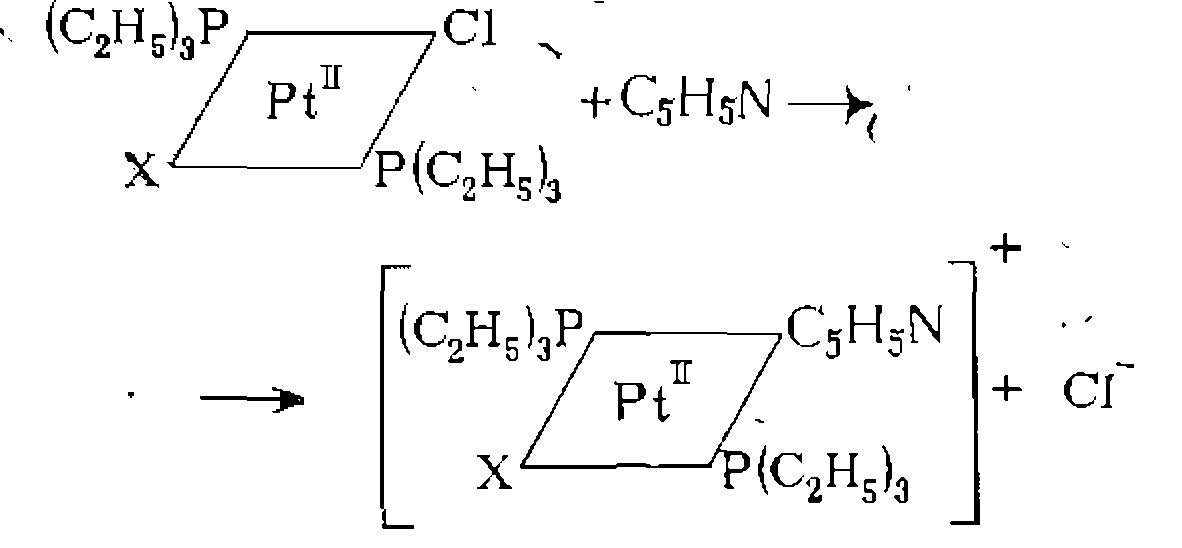
 в 10 000 раз выше, чем для комплекса
в 10 000 раз выше, чем для комплекса 
 18Г
18Г
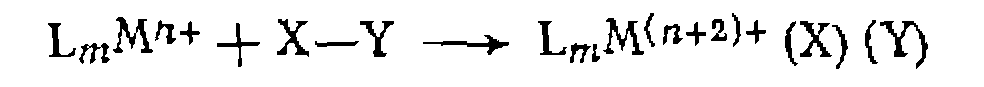
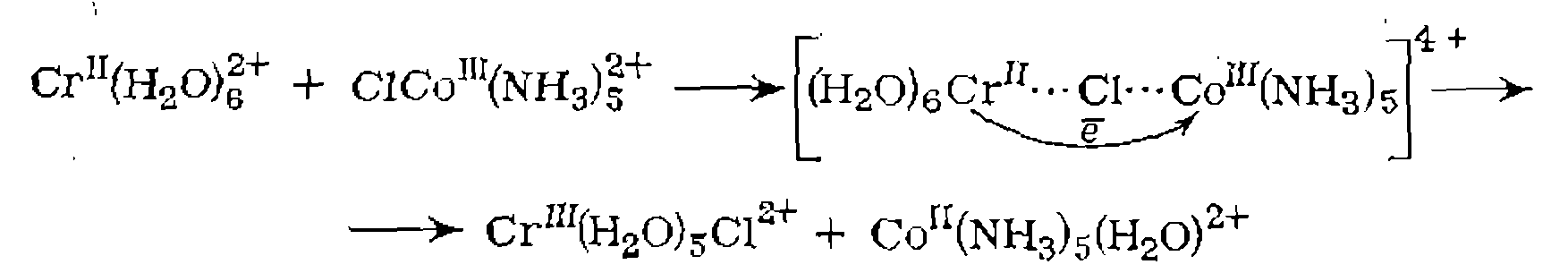
 , которые
, которые , например:
, например: 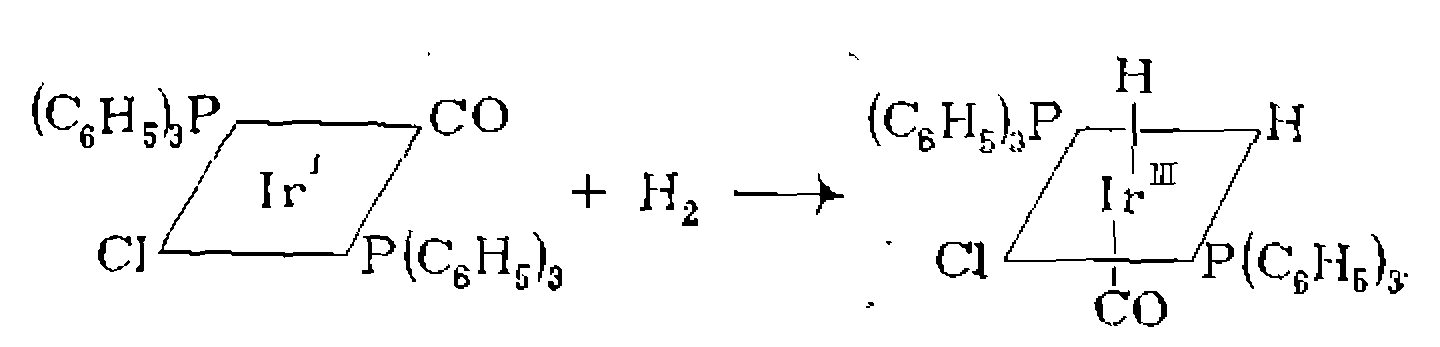
 например:
например:  ,
, . В реакцию окислительного присоединения вступают алкилгалогениды, галогены,, водород, галогенво- цороды, ацилхлориды, ангидриды карбоновых кислот по связи С—О, ароматические соединения по связям С—Н и G—X и др* Известно также окислительное присоединение по кратным связям
. В реакцию окислительного присоединения вступают алкилгалогениды, галогены,, водород, галогенво- цороды, ацилхлориды, ангидриды карбоновых кислот по связи С—О, ароматические соединения по связям С—Н и G—X и др* Известно также окислительное присоединение по кратным связям  с образованием трехчленных циклов, например:
с образованием трехчленных циклов, например: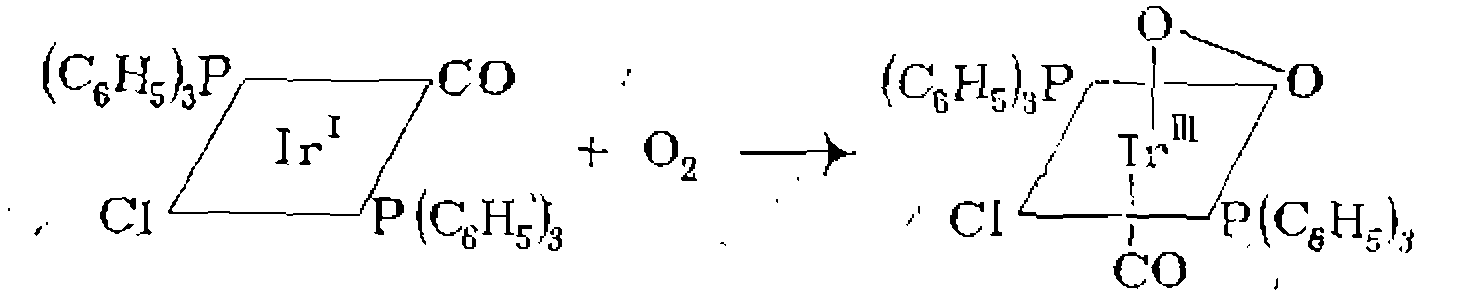

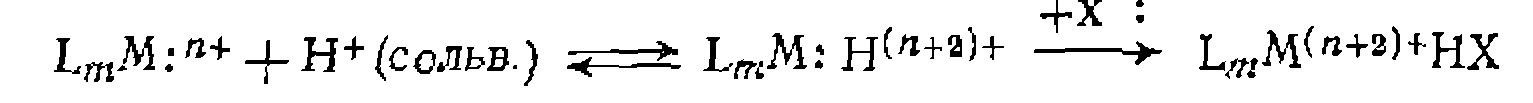
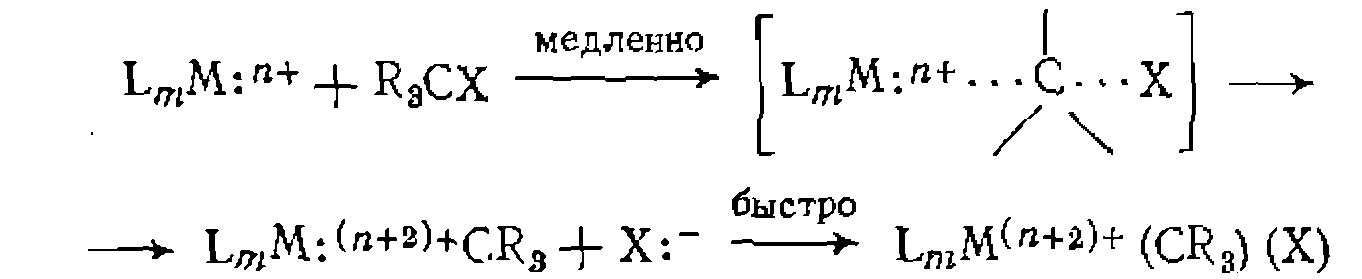
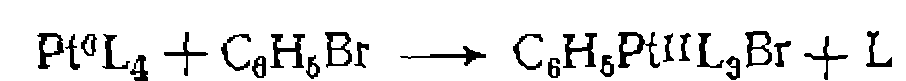
 и некоторых полярных реагентов в неполярных средах характерен синхронный механизм реакции, когда в одну элементарную стадию происходит ^ас-присоединение:
и некоторых полярных реагентов в неполярных средах характерен синхронный механизм реакции, когда в одну элементарную стадию происходит ^ас-присоединение: -реакциях):
-реакциях):
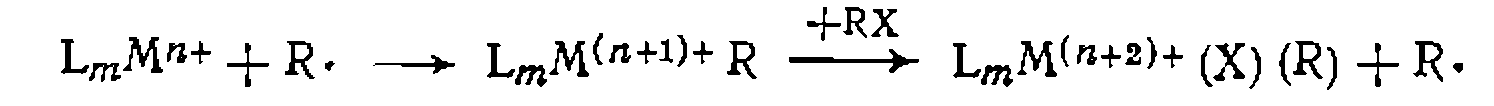
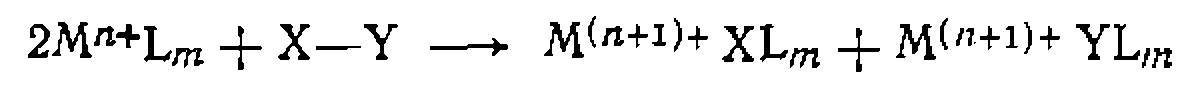

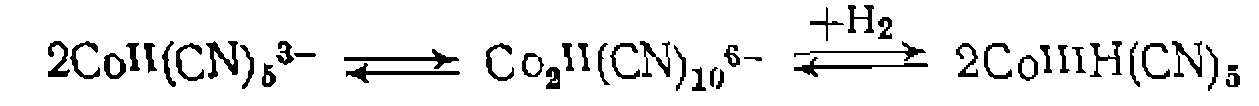
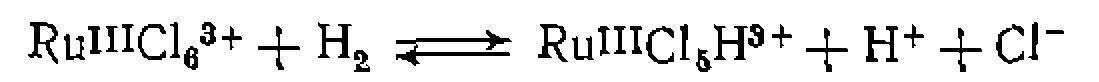

 —
—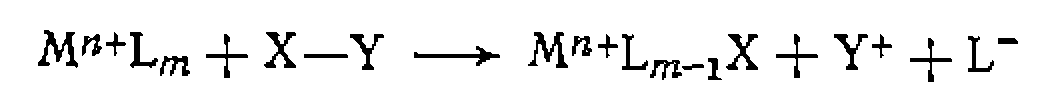


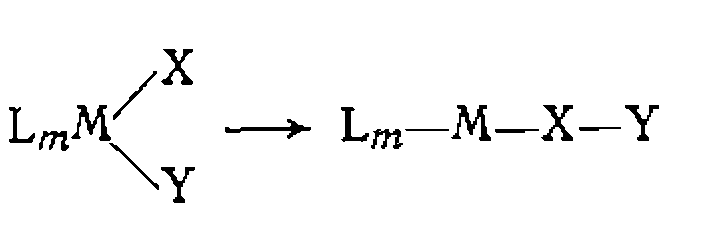
 связанного лиганда:
связанного лиганда:
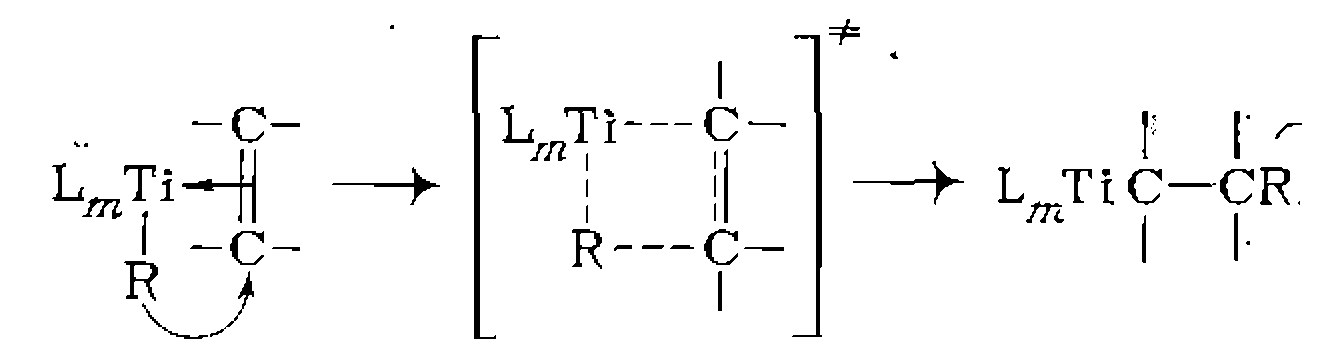
 координа
координа дока
дока
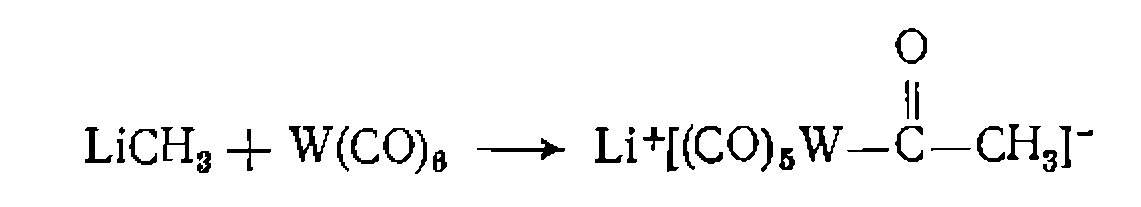
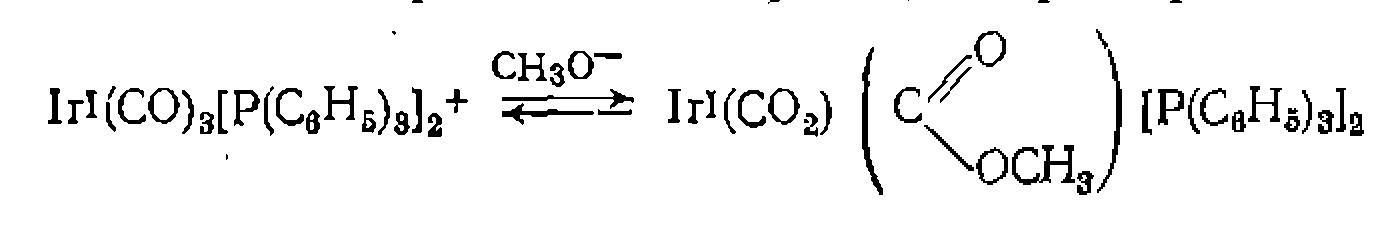
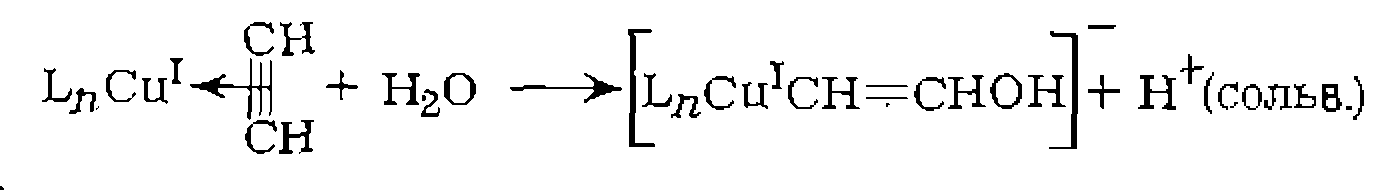
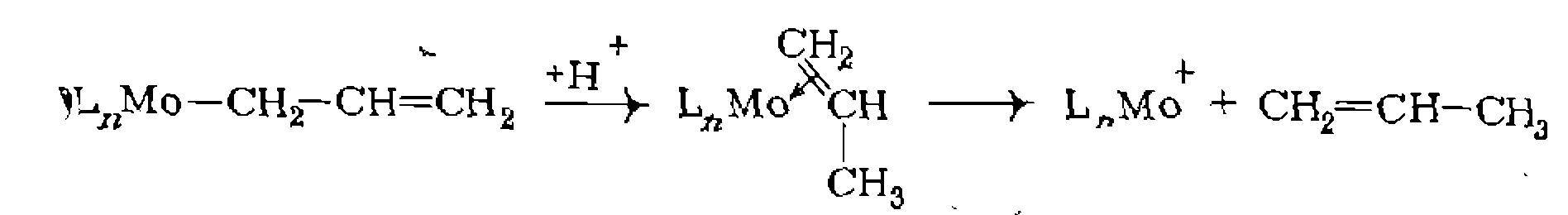
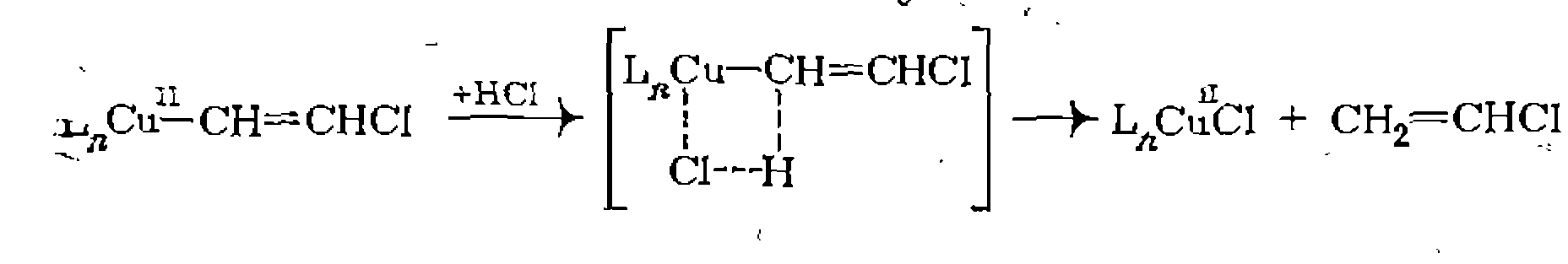
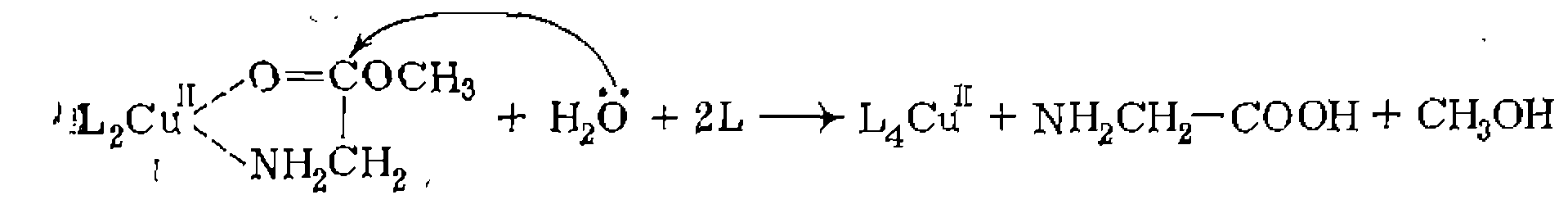
 и
и  Элиминирование.
Элиминирование.  Связанные с переходным металлом органические лиганды могут передавать металлу от
Связанные с переходным металлом органические лиганды могут передавать металлу от  или
или углеродного атома гидрид-ион,
углеродного атома гидрид-ион,  и некоторые другие
и некоторые другие углеродного атома -приводит к образованию олефина и гидрида металла. Эта реакция (представляет собой процесс, обратный рассмотренному выше внедрению олефина по связи М—Н в ряде случаев в действительности обратимому
углеродного атома -приводит к образованию олефина и гидрида металла. Эта реакция (представляет собой процесс, обратный рассмотренному выше внедрению олефина по связи М—Н в ряде случаев в действительности обратимому 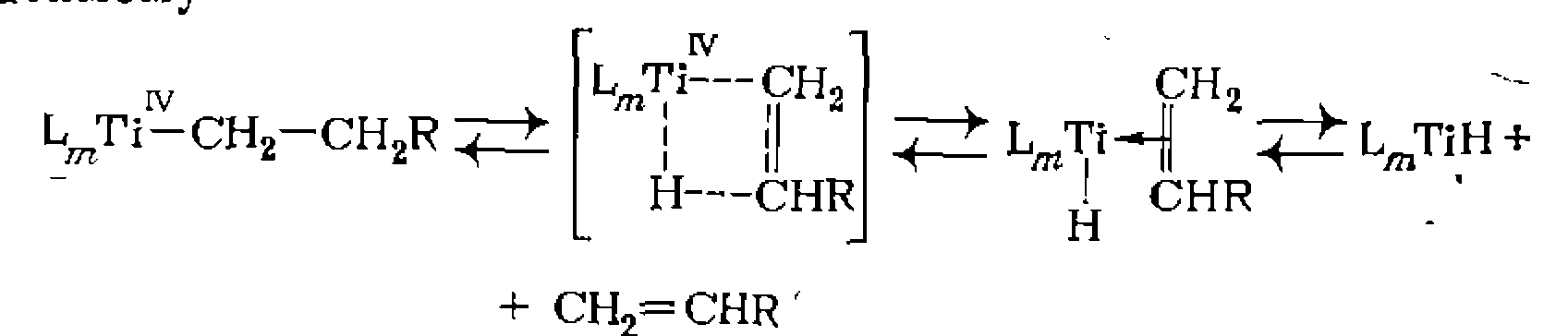
 углеродного атома. Подобные реакции приводят к образованию карбеновых комплексов, которые представляют собой каталитически активные частицы в реакциях диспропорционирования олефинов:
углеродного атома. Подобные реакции приводят к образованию карбеновых комплексов, которые представляют собой каталитически активные частицы в реакциях диспропорционирования олефинов:
 связи между находящимися в координационной сфере лигандами
связи между находящимися в координационной сфере лигандами  Новая частица или молекула X—Y покидает координационную сферу, а высвобождающаяся пара электронов остается у металла, который снижает свою степень окисления на два:
Новая частица или молекула X—Y покидает координационную сферу, а высвобождающаяся пара электронов остается у металла, который снижает свою степень окисления на два: