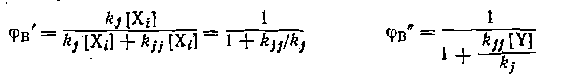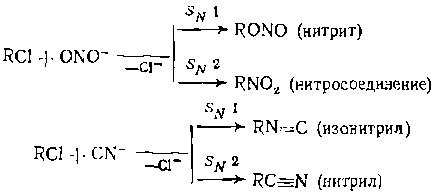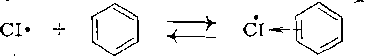|
|
СВЯЗЬ МЕХАНИЗМА И КИНЕТИКИ РЕАКЦИЙ С СЕЛЕКТИВНОСТЬЮ
По аналогии с интегральной селективностью процесса [уравнение (0-9)] можно ввести понятие дифференциальной селективности, которая представляет собой долю превращенного реагента А, израсходованную на образование данного продукта при бесконечно малом изменении состояния системы: Следовательно, дифференциальная селективность непосредственно связана с кинетикой, а значит, и с механизмом протекающих реакций, от которых так или иначе зависит и интегральная селективность. В выражения для rj из уравнения (II-57) входят концентрации или парциальные давления и константы скорости. При делении числителя на знаменатель оказывается, что кроме концентрационных факторов на селективность влияют соотношения констант скорости.
С точки зрения построения уравнений дифференциальной селективности (II-57) могут быть два предельных случая. При независимости маршрутов целевой и побочной реакций приходится подставлять, в выражение (11-57) кинетические уравнения этих реакций в целом. Например, при гидратации ацетилена с побочным образованием кротонового альдегида Тогда не обязательно знать кинетику реакций в целом, а достаточно ограничиться элементарными стадиями образования и расходования продуктов. Так, в предыдущих двух схемах механизмов получим:
Здесь селективность зависит от соотношения истинных констант элементарных стадий, причем концентрации промежуточных частиц и знаменатели кинетических уравнений сокращаются н уравнение селективности приобретает простой вид. Благоприятное для селективности соотношение констант скоростей зависит кроме температуры от многих факторов, которые нужно учитывать еще до кинетического этапа исследо Одним из примеров влияния механизма реакций на селективность является правило Корнблюма, согласно которому при Sjvl-замещении промежуточный карбкатиои преимущественно реагирует с нуклеофилом или с его реакционным центром, имеющим наибольшую электронную плотность или электроотрицательность, а при SN2-замещении—с нуклеофилом или с его реакционным центром, имеющим наибольшую поляризуемость. Вследствие этого нуклеофилы, обладающие двойственной реакционной способностью, в разных условиях реакции могут образовывать различные продукты:
Точно так же при обмене галогенов по SN2-механизму происходит замещение более электроотрицательного атома на более поляризуемый (Fи С1 на Вг и I). Однако при SN1-замещении наблюдается обратная картина и из RC1 получается RF, чему способствует катализатор SbFs, поляризующий связь С—С1. Следовательно, выбор условий, способных изменить механизм реакции (растворитель, катализатор и др.) ведет к изменению селективности и даже основного направления реакции. Важным для соотношения kj/kjjи селективности процесса является активность второго реагента или промежуточных частиц, непосредственно атакующих органическую молекулу. При этом наблюдается достаточно общее правило, состоящее в том, что с повышением их активности различие в константах скорости целевой и побочных реакций уменьшается. Это объясняют тем, что более активный реагент менее избирателен при атаке разных молекул или разных положений молекул. В приложении к замещению в ароматических соединениях это правило было установлено Брауном. Хорошей иллюстрацией этого являются гидролиз и щелочное дегидрохлорирование хлорпроизводных по SN2-механизмам. Согласно рассмотренному ранее механизму, в реакциях отщепления второй реагент выступает в качестве основания, отщепляющего протон, поэтому высокой селективности отщепления способствует применение сильных щелочей (NaOHи др.). Наоборот, при замещении важны нуклеофильные свойства второго реагента, которые зависят не только от основности, но и от поляризуемости. Применяя слабое основание, но достаточносильный нуклеофил (Na2CO3)
Одновременно с этим за счет изменения механизма реакции npirгидролизе содой предотвращается и значительное образование* простого эфира. В других реакциях, позволяющих изменять вид второго реагента, наблюдается сходная картина. Так, сульфирование можно проводить серной кислотой, олеумом и триоксидом серы, иг в этом же порядке увеличения активности снижается селективность реакций. При кислотном катализе ряда процессов увеличение силы кислот-катализаторов (H3P04<ArS020H<H2S04;: SnCl4<FeCl3<AlCl3) также дает снижение селективности. Другим примером реакций этого типа является радикальио- цепное хлорирование, где активной частицей, атакующей органическую молекулу, является атом хлора. Оказывается, что в» присутствии ароматического растворителя хлорирование протекает более селективно за счет снижения активности атома хлора, образующего с ароматическим соединением л-комплексы:
Следовательно, выбор подходящего растворителя способен обеспечить рост селективности. Активность реагента или частицы, атакующих органическую молекулу, и селективность зависят также от проведения реакции в газовой или жидкой фазе, что следует иметь в виду при выборе этих условий, когда это- возможно для данного процесса. Особый случай представляет влияние на селективность природы катализаторов. За исключением упомянутого раньше кислотного катализа, для большинства катализаторов других типов связь их строения или структуры с селективностью очень- сложна и пока выяснена лишь для некоторых частных случаев. Поэтому выбор катализаторов до сих пор проводится на основании предшествующих исследований или полуэмпирическим методами. Вопросы и упражнения 1.Для следующей системы реакций

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
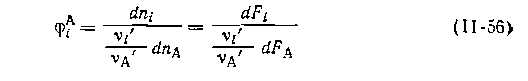

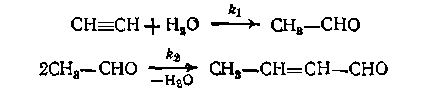
 slдифференциальная селективность равна: -
slдифференциальная селективность равна: -