
|
|
Изобара химической реакцииВлияние температуры на константу химического равновесия описывается уравнением: lnKp = Продифференцируем это уравнение по температуре при постоянном давлении и полученный результат сочетаем с уравнением Гиббса-Гельмгольца. Тогда окончательно получим зависимость
или отойдя от частных производных имеем dlnKp = Это уравнение получило название изобары химической реакции. Проанализируем его. 1. Пусть DH = const. Это может наблюдаться только в узком температурном интервале.
2. DH = f(T) и для всех участников реакции действительно уравнение
Рассмотрим несколько примеров решения задач. Задача 1. Найти константу равновесия реакции Fe2O3(т) + СО(г) ® 2FeO(т) + СО2(г) при 298 К и р = 1,0135 × 105 Па, если
DGp = 2DG(FeO(т)) + DG(СО2(г)) – DG(Fe2O3(т)) – DG(СО(г)); DGp = –394,4 – 2 × 254,2 + 741 + 132,2; DGp = –29,6 кДж/моль = –29600 Дж/моль. DG = –RTlnKp
Кр = 1,55 × 106. Высокое значение величины Кр указывает, что реакция практически идет до конца. Задача 2. Степень диссоциации фосгена по реакции COCl2 ⇆ CO + Cl2 при 600 °С и 1,38 × 105 н/м2 равна 0,9. Определить в каком направлении будет протекать процесс при следующих заданных значениях парциальных давлений компонентов:
Определяем константу равновесия реакции COCl2 ⇆ CO + Cl2 n(1 – a) na na
После подстановки и простых преобразований получаем
Направление процесса определяем по изменению изобарного потенциала DG, которое вычисляем по уравнению изотермы химической реакции. Для первого случая:
Следовательно, в первом случае протекание процесса в прямом направлении возможен. Для второго случая:
Следовательно, во втором случае система находится в равновесии. Для третьего случая:
Следовательно, в третьем случае процесс в прямом направлении неосуществим, но возможен в обратном направлении. Задача 3. Давление диссоциации NiO при 600 °С равно 4 × 10–17 мм.рт.ст. Определить изменение изобарного потенциала для реакции 2Ni(т) + О2(г) ⇆ 2NiO(т) при этой температуре, если кислород взят под давлением 1,013 × 105 н/м2. Определяем константу равновесия данной реакции
Определяем изменение изобарного потенциала:
Задача 4. Возможен ли термодинамический процесс получения анилина из хлорбензола и аммиака по уравнению С6H5Cl(ж) + NH3(г) ⇆ С6H5NH2(ж) + HCl(г), если известны стандартные изменения изобарного потенциала образования веществ, входящих в данную реакцию: DG0(С6H5Cl) = 198,4 кДж/моль; DG0(NH3) = –16,63 кДж/моль; DG0(С6H5NH2) = 153,1 кДж/моль; DG0(HCl) = –95,28 кДж/моль. Вычисляем стандартное изменение изобарного потенциала реакции DG Следовательно, процесс возможен. Задачи для самостоятельного решения Задача 5. Для реакции H2 + I2 ⇆ 2HI KC = 50 при 444 °С. Определить направление процесса, если исходная смесь имеет следующий состав: Задача 6. Константа диссоциации N2H4 по уравнению N2H4 ⇆ 2NO2 при 50 °С равна 0,797 × 105 н/м2. Определить направление процесса при следующих исходных значениях парциальных давлений компонентов:
* 1 н/м2 = 1 Па
Задача 7. Для реакции Н2О ⇆ Н2 + ½О2 при 1500 °С и 1,013 × 105 н/м2 a = 2,21 × 10–4. Определить в каком направлении будет протекать процесс при следующих значениях исходных парциальных давлений компонентов:
Задача 8. Для реакции СО2 ⇆ СО + ½О2 при 1500 К и 1,013 × 105 н/м2 a = 4,8 × 10–4. Определить в каком направлении будет протекать процесс при следующих значениях исходных парциальных давлений компонентов:
Задача 9. При 600 °С константа равновесия реакции CO + Cl2 ⇆ COCl2 равна Кр = 1,678 × 10–6 (н/м2)–1. Вычислить максимальную работу образования 1 моля COCl2 при этой температуре и парциальном давлении 0,507 × 105 н/м2, если CO и Cl2 взяты при парциальных давлениях соответственно 2,026 × 105 и 3,039 × 105 н/м2. Задача 10. Для реакции СО + Н2О ⇆ СО2 + Н2 при 1500 К величина Кр = 0,31. Определить в каком направлении пойдет процесс при следующих значениях исходных парциальных давлений компонентов:
Задача 11.Для реакции SO2Cl2 ⇆ SO2 + Cl2 при 30 °C значение Кр = 2,88 × 103 н/м2. Определить в каком направлении пойдет процесс при следующих значениях исходных парциальных давлений компонентов:
Задачи 2 – 11 заимствованы в книге Картушинской А.И., Лельчук Х.А., Стромберга А.Г. Сборник задач по химической термодинамике. М.: Высшая школа. 1973. 224 с.
ЛИТЕРАТУРА Основная литература 1. Шель Н.В., Синютина С.Е., Романцова С.В. Органическая химия. Тамбов: Изд-во ТГУ им. Г.Р. Державина. 2004. 199 с. 2. Абакумова Н.А. Органическая химия. Тамбов: Изд-во ТГТУ. 2004. 3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. М.: Высшая школа. 1981. 592 с. 4. Артеменко А.И. Органическая химия. М.: Высшая школа. 2000. 559 с. 5. Семчиков Ю.Д. Высокомолекулярные соединения. М.: Издательский центр «Академия». 2008. 368 с. 6. Леонова В.Ф. Термодинамика. М.: Высшая школа. 1968. 159 с. 7. Эверет Д. Введение в химическую термодинамику. М.: Издат. иностр. литературы. 1963. 300 с. 8. Путилов К.А. Термодинамика. М.: Наука. 1971. 375 с. 9. Даниэльс Ф., Альберти Р. Физическая химия. М.: Высшая школа. 1967. 784 с. 10. Уильямс В., Уильямс Х. Физическая химия для биологов. М.: Мир. 1976. 600 с. 11. Добычин Д.П., Каданер Л.И., Серпинский В.В., Буркат Т.М., Ганелина Е.Ш., Лобов В.И. Физическая и коллоидная химия. М.: Просвещение. 1986. 463 с. Дополнительная литература 12. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. М.: Химия. 1969. Т. 1. 663 с. 13. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. М.: Химия. 1970. Т. 2. 824 с. 14. Робертс Дж., Касерио М. Основы органической химии. М.: Мир. Т. 1. 1998. 842 с. 15. Пригожин И., Кондепуди Д. Современная термодинамика. М.: Мир. 2009. 461 с. 16. Судариков С.А., Капуцкий Ф.Н. Физическая химия. Минск: Высшая школа. 1981. 312 с. 17. Николаев Л.А., Тулупов В.А. Физическая химия. М.: Высшая школа. 1964. 441 с. 18. Вигдорович В.И., Цыганкова Л.Е. Экология. Химические аспекты и проблемы. Тамбов: Изд-во ТГУ им. Г.Р. державина. Ч. I. 1994. 148 с. 19. Вигдорович В.И., Цыганкова Л.Е. Экология. Химические аспекты и проблемы. Тамбов: Изд-во ТГУ им. Г.Р. державина. Ч. II. 1995. 220 с. 20. Корже Ф., Бахадир М., Клайн В., Лай Я.П., Паллар Г., Шойверт И. Экологическая химия. М.: Мир. 1997. 396 с. 21. Вигдорович В.И., Ситнер Е.Я. Химия и экология гидросферы. Тамбов: Изд-во ТГУ им. Г.Р. державина. 2000. 204 с. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 .
.
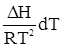 .
.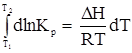
 .
. .
. (Fe2O3) = –741 кДж/моль;
(Fe2O3) = –741 кДж/моль; ;
;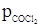 , н/м2
, н/м2
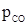 , н/м2
, н/м2
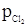 , н/м2
, н/м2
 ;
;  ;
; 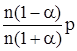 .
. н/м2.
н/м2.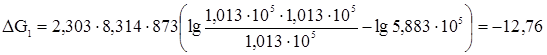 кДж.
кДж. .
.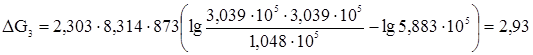 кДж.
кДж. ,
, равно 4 × 10–17 мм.рт.ст., или
равно 4 × 10–17 мм.рт.ст., или 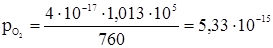 н/м2; отсюда
н/м2; отсюда 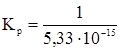 (н/м2)–1.
(н/м2)–1. кДж.
кДж. =S(nDG0)прод–S(nDG0)исх=153,1 –95,28+16,63–198,4= –123,95 кДж.
=S(nDG0)прод–S(nDG0)исх=153,1 –95,28+16,63–198,4= –123,95 кДж. = 2 моль/л;
= 2 моль/л;  = 5 моль/л;
= 5 моль/л;  = 10 моль/л.
= 10 моль/л. , н/м2*
, н/м2*
 , н/м2*
, н/м2*
 , н/м2
, н/м2
 , н/м2
, н/м2
 , н/м2
, н/м2
 , н/м2
, н/м2
 , н/м2
, н/м2