|
|
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯГетероциклическими соединениями (гетероциклами) называют циклические органические соединения, в состав атомов циклов которых, помимо углеродных, входят атомы других химических элементов – гетероатомы. Наибольшее значение имеют гетероциклические соединения, в которых в состав пяти- и шестичленных колец входят атомы азота, кислорода и серы. Приведем вначале некоторые примеры. Гетероциклы можно классифицировать как по признаку входящих в них гетероатомов (II – V), так и по числу гетероатомов в цикле (I).
Ароматичность пятичленных гетероциклов с двумя p-связями объясняется тем, что одна свободная пара электронов атомов N, S, O действует в ароматической (подобно бензолу) делокализации и образовании ароматического секстета. Пятичленные гетероциклы с одним гетероатомом
Получение фурана 1. Общий метод его синтеза основан на дегидратации уже знакомых читателям алифатических 1,4-диолов.
Химические свойства фурана 1. Окисление
2. Окисление фурана на воздухе сопровождается полимеризацией. 3. Первой стадией взаимодействия с сильными кислотами является реакция:
4. Несмотря на малую стабильность, фуран способен к реакциям электрофильного замещения (сульфирование, нитрование).
Получение пиррола Его синтезируют по следующим реакциям: 1. Действие аммиака на 1,4-дигидроксисоединения (реакция Пиаль-Кнорра).
2. Пропускание паров фурана с аммиаком над Al2O3 (400 °C).
Химические свойства пиррола 1. Восстановление водородом.
2. Взаимодействие с металлическим калием.
Получение имидазола
Химические свойства имидазола Имидазол – сильное основание (сильнее пиридина).
2. Взаимодействует с реактивом Гриньяра.
Шестичленные гетероциклы Пиридин Он обладает сильными основными свойствами (Кв = 1,8 × 10-9), имеет сильный неприятный запах, смешивается с водой в любых отношениях. Его дипольный момент – 2,2 Дебая. Пиридин можно рассматривать как аналог бензола, в котором одна СН-группа замещена атомом азота.
Далее их разделяют. Химические свойства пиридина 1. Взаимодействует с амидом натрия (реакция А.Е. Чичибабина).
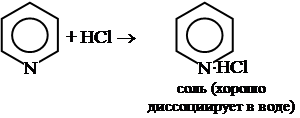
2. Взаимодействует с сильными кислотами с образованием соли.
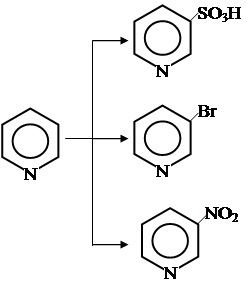
3. Пиридин индифферентнее бензола. В жестких условиях он нитруется, сульфируется, бромируется с низким выходом в b-положение. Второй заместитель ввести не удается.
ДИОКСИНЫ Рассмотрим более подробно химию и проблему диоксинов. В последние десятилетия появилась опасность общепланетарного отравления среды нашего обитания диоксинами – опаснейшими экотоксикантами. Формула одного из них имеет вид:
В целом, он является представителем многочисленной группы диоксиноподобных веществ – чужеродных живым организмам – ксенобиотиков, поступающих в биосферу с продукцией или отходами многочисленных технологий. В отличие от целого ряда других ксенобиотиков, например, хлорорганических пестицидов, диоксины никогда не являлись целевым технологическим продуктом, а лишь сопутствовали таковым в виде микропримесей. В связи с этим их воздействие долгое время оставалось незамеченным. Однако именно примеси этих экотоксикантов, характеризующихся комплексом необычных физико-химических свойств и уникальной биологической активностью, делают их в будущем опаснейшим источником долговременного заражения биосферы, более серьезным, чем, например, заражение хлорорганическими пестицидами. Они во все более возрастающих масштабах генерируются, выбрасываются в природную среду и аккумулируют в ней. Пример накопления ксенобиотиков в биосфере не знает ни пределов насыщения, ни национальных границ, ни серьезных естественных путей их деградации. Следовательно, ждать установления каких-либо равновесий сегодня не приходится, то есть процесс нацело сдвинут в сторону образования диоксинов. Ситуация такова, что их концентрация в гидросфере и литосфере может достичь критических величин, ведущих к необратимому поражению живого вещества. Знакомство человека с диоксинами началось в 1930 г, когда применение полихлорфенолов привело к появлению массовых профессиональных заболеваний хлоракне – рецидивирующего воспаления сальных желез. География хлоракне значительно расширилась с созданием крупнотоннажных производств 2,4,5-трихлорфенола
и гербицидов на его основе. Источником заболевания оказалось индивидуальное вещество (2,3,7,8-ТХДД), причем выяснилось, что рецидивы хлоракне проявляются через
Особое внимание к себе этот ксенобиотик привлек как микропримесь к полихлорбифенилам (ПХБ), используемым в качестве жидких диэлектриков,
Наличие микропримесей (III) и (IV) в продукции хлорных производств явилось причиной многочисленных фактов отравления людей в 60-е, 70-е и 80-е годы. Попадание их в корм кур-несушек неоднократно приносило большой ущерб бройлерной промышленности. Поражение людей и длительное заражение ксенобиотиками (III) и (IV) различных объектов наблюдалось многократно при непродуманной утилизации отходов хлорных производств, при пожарах в электросиловых системах, где сосредоточено большое количество пыли хлорвиниловых электроизоляционных материалов. Схематично процесс протекает следующим образом:
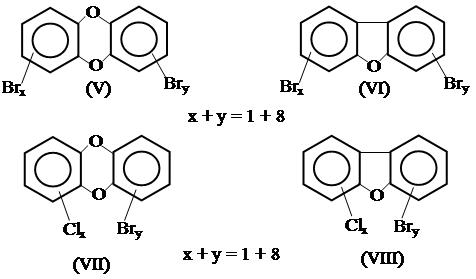
В ряде случаев даже более опасными, чем (III) и (IV), являются смешанные полихлорбромсодержащие дибензо-п-диоксины и дибензофураны
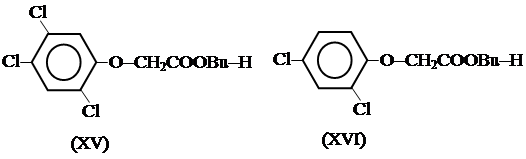
В последние 30 лет вопросы заражения биосферы диоксинами обсуждаются общественностью, политическими кругами, ставятся представителями «зеленого» движения. Этому способствовал ряд событий. Одно из них – война во Вьетнаме, во время которой на территории Южного Вьетнама войсками США (1962 – 1970 гг) было применено 57 тысяч тонн гербицида «Эйджент оранж» (ЭО), содержащего только по официальным данным, которые в таких случаях обычно существенно занижаются, 170 кг диоксина (I). Многочисленные сообщения о массовом поражении населения этого района и участников войны, негативное влияние гербицида на детородные функции женщин и отдаленные последствия поражения вызвали тревогу, так как компоненты ЭО (смесь бутилового эфира 2,4,5-трихлорфеноуксусной кислоты (2,4,5-т(ХУ)) с примесями (I) и бутилового эфира 2,4-дихлорфеноуксусной кислоты (XVI) широко применялись в сельском хозяйстве
Были и другие очень серьезные события, но достаточно и описанного выше, чтобы вызвать повышенное внимание к проблеме диоксинов. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 К ним относятся фуран, тиофен, пиррол и их гидрированные производные:
К ним относятся фуран, тиофен, пиррол и их гидрированные производные:
 2. Синтезируют его и по реакции:
2. Синтезируют его и по реакции: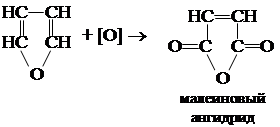


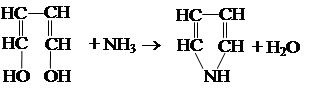



 3. Взаимодействие с магнийорганическими соединениями.
3. Взаимодействие с магнийорганическими соединениями. Получают действием на глиоксаль формальдегида и аммиака.
Получают действием на глиоксаль формальдегида и аммиака. 1. Взаимодействует с сильными кислотами с образованием солей.
1. Взаимодействует с сильными кислотами с образованием солей.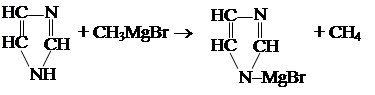
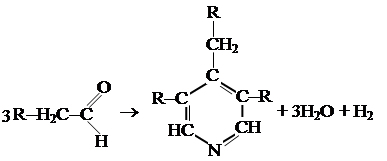 Получение пиридина достаточно сложно. При пропускании смеси альдегидов RCH2CHO с аммиаком над Al2O3 (400 °C) получается смесь гомологов пиридина.
Получение пиридина достаточно сложно. При пропускании смеси альдегидов RCH2CHO с аммиаком над Al2O3 (400 °C) получается смесь гомологов пиридина.



 теплоносителей, гидравлических жидкостей. Вызванные (II) массовые отравления в Японии (1968 г) и на Тайване (1978 г) связаны с попаданием ПХБ в рисовое масло, что привело к болезни Юшо (острое поражение печени с многочисленными побочными эффектами). Было показано, что ксенобиотики (I) и (II), как и многие другие представители полихлорированных дибензо-п-диоксинов (ПХ ДД, (III)) и дибензофуранов (ПХДФ (IV)) имеют сходные токсикологические характеристики.
теплоносителей, гидравлических жидкостей. Вызванные (II) массовые отравления в Японии (1968 г) и на Тайване (1978 г) связаны с попаданием ПХБ в рисовое масло, что привело к болезни Юшо (острое поражение печени с многочисленными побочными эффектами). Было показано, что ксенобиотики (I) и (II), как и многие другие представители полихлорированных дибензо-п-диоксинов (ПХ ДД, (III)) и дибензофуранов (ПХДФ (IV)) имеют сходные токсикологические характеристики.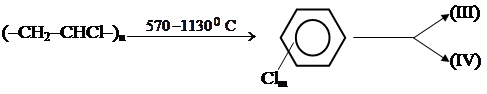
 Биологической активностью, характерной для (I), обладают и многие другие галогенорганические соединения. В том числе и некоторые трициклические, например, полихлор-, полибром- или полихлорбромксантены (IX), ксантоны (X), бифенилы (XI),
Биологической активностью, характерной для (I), обладают и многие другие галогенорганические соединения. В том числе и некоторые трициклические, например, полихлор-, полибром- или полихлорбромксантены (IX), ксантоны (X), бифенилы (XI), а также ряд бициклических соединений типа бифенилов (XII), полихлоразо- (XIII) и полихлоразооксибензолы (XIV).
а также ряд бициклических соединений типа бифенилов (XII), полихлоразо- (XIII) и полихлоразооксибензолы (XIV).