
|
|
Связь DH и DU химических реакцийДанные по изменению внутренней энергии системы при протекании химических реакций в справочниках отсутствуют. Эти величины рассчитывают с учетом значений DHреакции. Рассмотрим ситуацию при постоянном давлении. Учитывая, что Нi = Ui + pVi, можно записать DН = DU + pDV или DН = DU + (pV2 – рV1). (17) При наличии в системе конденсированных (жидких и твердых) и газообразных веществ, объемами первых можно пренебречь. Учтем, что имеет место равенство pVi = niRT, тогда можно записать pV2 – рV1 = n2RT - n1RT. (18) Сочетая уравнения (17) и (18), получим DН = DU + n2RT - n1RT и DН = DU + RTDn, откуда DU = DН - RTDn, Dn – разность количества моль газообразных продуктов реакции и исходных веществ, которую можно рассматривать как соответствующую разность стехиометрических коэффициентов в уравнении реакции. Задача. Найти изменение внутренней энергии в процессе протекания реакции С6Н6(ж) + 7½О2(г) = 6СО2(г) + 3Н2О(ж) при 25 0С, если расчет показал, что DH DU = DН - RTDn Dn = 6 – 7½ = –1½ DU = -185970 - 8,31 × 298 × (–1½) DU = -182255 Дж. Зависимость тепловых эффектов от температуры. Закон Кирхгофа Теплоты химических реакций, как уже наверняка отметил внимательный читатель, не являются постоянными величинами. Из уже изложенного выше следует, что они являются функциями температуры, хотя подчас в достаточно узком температурном интервале (30 … 40 °С) их рассматривают как константы. Их знание необходимо при оценке многих показателей, в частности, при расчетах тепловых балансов реакторов, в которых проводятся процессы при повышенных температурах. Одновременно учтем, что большинство химических процессов в промышленности проводится при постоянном давлении, хотя существенны и изохорические маршруты. Ранее отмечалось, что из самых общих соображений Qp = H2 – H1 и QV = U2 – U1. Используя понятие Сp и CV, введенные ранее, можно записать
и
где Сi – мольные теплоемкости, а нижние индексы 1 и 2 характеризуют совокупности конечных продуктов и исходных веществ. Совершенно очевидно, что разности Сi можно выразить через уравнение
где н и к в нижних индексах относятся к исходным и конечным участникам реакции. Иначе говоря
DНТ,2 = DНТ,1 + или DТТ,2 = DН298 + Зависимость теплоемкости от температуры выражается в виде одного из двух эмпирических степенных рядов: Ср = а + bТ + сТ2 (22а) или Ср = а + bТ + с¢Т-2. (22б) Тогда DСр = Dа + DbТ + DсТ2 + Dс¢Т-2 (23) После подстановки уравнения (22) в (21) и интегрирования получим DНТ,2 = DНТ,1+Dа(Т2 – Т1)+ Если в справочнике для соответствующих веществ отсутствуют данные по величинам с и с¢, то соответствующий член уравнения (24) не учитывается. Задача 1. Определить зависимость теплового эффекта реакции 2Н2(г) + СО(г) = СН3ОН(г) от температуры при постоянном давлении, если стандартные теплоты образования для СО(г) и СН3ОН(г) соответственно равны -110,5 и
Вычислить тепловой эффект этой реакции при 500 К и постоянном давлении. 1. Определяем DСр по уравнению (23) Dа = 15,28 - 28,41 - 2 × 27,28 = -67,69, Db = 105,2 × 10-3 - 4,10 × 10-3 - 2 × 3,26 × 10-3 = 94,58 × 10-3, Dс = -31,04 × 10-6 Dс¢ = 0,46 × 105 - 2 × 0,502 × 105 = -0,544 × 105, отсюда DСр = -67,69 + 94,58 × 10-3Т - 31,04 × 10-6Т2 - 0,544 × 105Т-2. 2. Определяем тепловой эффект реакции при стандартных условиях для температуры 298 К на основании первого следствия из закона Гесса, пользуясь теплотами образования веществ, входящих в данную реакцию DН298 = -201,2 + 110,5 = -90,7 кДж, или -90700 Дж. DНТ,2 = DНТ,1-67,69(Т2–Т1)+
Примем DНТ,1 º DН298. Тогда имеем: DН500 = -90700 -67,69(500–298) +
DНТ,2 = -97750 Дж. Задача 2. Мольная теплота испарения метилового спирта при 25 °С составляет 37,4 кДж/моль. Определить теплоту испарения метилового спирта при 50 °С, если мольная теплоемкость жидкого и газообразного метилового спирта соответственно равны 81,6 и 43,9 Дж/моль×град. Считать теплоемкость в интервале температур 25 – 50 ° практически постоянной. Согласно уравнению (21) DН2,исп = DН1,исп + DН2,исп = 37400 + Задача 3. Найти изменение энтальпии сгорания пропана при температуре 1000 К, приняв: DH DH DH Ср(Н2О(пар)) = 30 + 0,017Т; Ср(С3Н8) = 1,72 + 0,27Т; Ср(СО2) = 44,14 + 0,009Т; Ср(О2) = 31,41 + 0,003Т. В данном случае решение проводим с использованием упрощенной зависимости Сp,i, приняв, что первые два члена вносят основной вклад. Записываем уравнение реакции С3Н8 + 5О2 = 3СО2 + 4Н2О(пар) DH Dа = 4 × 30 + 3 × 44,14 -1,72 - 8,6 = 242,1 Дж/моль×К Db = 4 × 0,017 + 3 × 0,009 -0,27 - 5,0 × 0,003 = -0,19 Дж/моль×К DН DН Средняя теплоемкость Часто в расчетах тепловых эффектов реакций находит применение средняя теплоемкость веществ в некотором температурном интервале Т1 – Т2, которая рассчитывается по уравнению
где q – теплота, необходимая для нагревания вещества или системы в пределах от Т1 до Т2, где Т1 – Т2 – границы температурного интервала. При изменении температуры от Т1 до Т2 количество поглощенной теплоты равно DН = DН = С другой стороны q = Так как q º DН, приравняем правые части последних уравнений.
Если Т1 = 0, имеем
Если пренебречь третьим членом правой части (ввиду его малости), получим
Qp º DН = 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
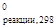 = -185970 Дж.
= -185970 Дж.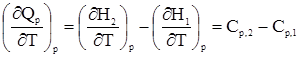
 ,
,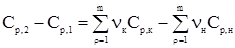
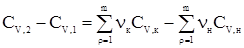 ,
,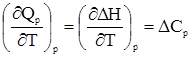 , (19)
, (19) , (20)
, (20) – разность сумм молярных теплоемкостей
– разность сумм молярных теплоемкостей 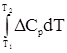 (21)
(21) . (22)
. (22) ¢
¢  (24)
(24) = 27,28 + 3,26 × 10-3Т + 0,502 × 105Т-2 Дж/моль×град
= 27,28 + 3,26 × 10-3Т + 0,502 × 105Т-2 Дж/моль×град = 28,41 + 4,10 × 10-3Т - 0,46 × 105Т-2 Дж/моль×град
= 28,41 + 4,10 × 10-3Т - 0,46 × 105Т-2 Дж/моль×град = 15,28 + 105,2 × 10-3Т + 3,104 × 105Т-5 Дж/моль×град
= 15,28 + 105,2 × 10-3Т + 3,104 × 105Т-5 Дж/моль×град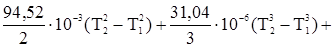

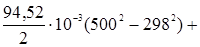


 .
. = 36460 Дж/моль, или 36,46 кДж/моль.
= 36460 Дж/моль, или 36,46 кДж/моль.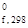 (С3Н8) = -103,85 кДж/моль;
(С3Н8) = -103,85 кДж/моль; = 3(-241,8) + 4(-393,51) + 103,85 = -2196,4 кДж/моль =
= 3(-241,8) + 4(-393,51) + 103,85 = -2196,4 кДж/моль = 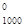 = DН
= DН  +
+ 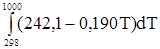
 (1000000 – 88804) =
(1000000 – 88804) = =
=  ,
, ,
,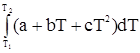 .
. (T2 – T1).
(T2 – T1).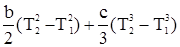
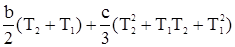 .
. .
. .
. .
.