
|
|
Расчет изменения энтропии идеального газаРассмотрим переход системы из идеального газа из одного состояния в другое. Из самых общих соображений в отсутствии химических изменений в системе можно записать (для 1-го моля газа):
pV = RT и, следовательно,
Окончательно получаем:
Для n молей газа уравнение будет иметь вид:
Учтем, что для идеального газа
Откуда
В случае изотермического процесса имеем:
Расчет изменения энтропии реальных газов и В этом случае следует исходить из уравнения
Учтем, как было указано ранее, зависимость Ср от температуры может быть выражена степенными рядами, в частности, в соответствии с уравнениями (22а) и (22б). Тогда можно записать для первого случая
В случае n молей конденсированного вещества или реального газа будем иметь:
В широком интервале температур возможны агрегатные превращения вещества. Тогда до и после агрегатного превращения меняется вид зависимости Ср вещества от температуры, то есть коэффициенты степенных рядов. Собственно фазовый переход происходит при постоянной температуре, иначе говоря:
В общем виде в отсутствие химического превращения вещества уравнение для расчета имеет вид:
li в расчете на 1 моль – мольная теплота фазового перехода Приведем пример решения задач, связанных с расчетом изменения энтропии, а также несколько задач для самостоятельного решения (все задачи заимствованы в книге: Картушинская А.И, Лельчук Х.А., Стромберг А.Г. Сборник задач по химической термодинамике. М.: Высшая школа. 1973. Задача 1. Определить изменение энтропии при превращении 2 г воды в пар при изменении температуры от 0 до 150°С и давлении в 1,013 × 105 Н/м2, если скрытая удельная теплота парообразования воды DН = 2,255 кДж/г, а мольная теплоемкость пара при постоянном давлении Ср = 30,13 + 11,3 × 10-3 Т Дж/моль × град. Ср жидкой воды = 75,30 Дж/моль × град. Считать, что в первом приближении, теплоемкость жидкой воды постоянна. Указанный процесс состоит из трех стадий: 1) нагрева жидкой воды от 0 до 100 °С, 2) перехода жидкой воды в пар при 100 °С, 3) нагрева водяного пара от 100 до 150 °С. 1. Изменение энтропии в стадии 1 рассчитывается по формуле
учитывая, что Сp = const,
2. Изменение энтропии в стадии 2 определяется по формуле (28) с учетом количества вещества воды
3. Изменение энтропии в стадии 3 рассчитывается по формуле (29)
Общий прирост энтропии составит DS = DS1 + DS2 + DS3 = 2,61 + 12,09 + 0,49 = 15,19 Дж/град. Задача 2. В одном из сосудов емкостью 0,1 м3 находится кислород, в другом емкостью 0,4 м3 – азот. В обоих сосудах температура 17 °С и давление 1,013 × 105 Н/м2. найти изменение энтропии при взаимной диффузии газов из одного сосуда в другой при р и Т = const. Считать оба газа идеальными. Изменение энтропии определяем по формулам:
или
так как объем V пропорционален количеству вещества идеального газа n. Число молей каждого газа находим из уравнения Менделеева-Клапейрона.
Задача 3. Вычислить изменение энтропии в процессе изотермического расширения 2 моль метана от р1 = 101,3 × 105 Н/м2 до р2 = 1,013 × 105 Н/м2. Газ считать идеальным. По формуле
при Т = const находим
Задачи для самостоятельного решения (В условиях задач предполагается, что газы и пары подчиняются законам идеальных газов) Задача 4. Рассчитать мольную энтропию оксида углерода при 200 °С и давлении 50,67 × 105 Н/м2, если энтропия при 25°С и 1,013 × 105 Н/м2 равна 197,9 Дж/град×моль, а зависимость мольной теплоемкости от температуры выражается уравнением Ср = 28,41 + 4,10 × 10-3 Т – 0,46 × 105Т-2 Дж/моль × град. Задача 5. Вычислить изменение энтропии при нагревании 1 кмоль сульфида кадмия от -100 до 0 °С, если зависимость мольной теплоемкости от температуры в интервале от 140 до 300 К выражается уравнением. Ср = 54,0 + 3,8 ×10-3 Т Дж/моль × град. Задача 6. Найти изменение энтропии при нагревании 1 моля кадмия от 25 до 727°С, если температура его плавления 321°С и молярная теплота плавления равна 6109 Дж/моль: С С Задача 7.Какому конечному объему отвечает изменение энтропии, равное 38,28 Дж/моль × град, если 1 моль идеального газа, занимающий в данных условиях 0,02 м3, изотермически расширяется. Задача 8. Насколько изменится энтропия в процессе изотермического расширения 10 г криптона от объема 0,05 м3 и давление 1,013 × 105 Н/м2 до объема 0,2 м3 и давления 0,2133 × 105 Н/м2? Задача 9. Определить изменение энтропии, если 0,0112 м3 азота нагреваются от 0 до 50°С. Одновременно давление уменьшается от 1,013 × 105 Н/м2 до 1,013 × 103 Н/м2. Теплоемкость равна 29,29 Дж/моль × град. Задача 10. Найти изменение энтропии при изотермическом сжатии Задача 11. Вычислить изменение энтропии при смешении 0,001 м3 водорода с 0,0005 м3 метана, если исходные газы и образующаяся смесь газов находятся при 25°С и 0,912 × 105 Н/м2. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ;
; ;
; ;
;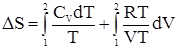 ;
; .
.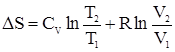 ; (при CV ¹ f(T)).
; (при CV ¹ f(T)).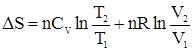 .
.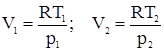 .
.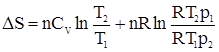 ;
; ;
;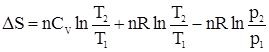 ;
;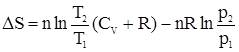 ;
; .
. и
и  .
. .
. ;
;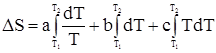 ;
;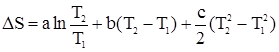 .
.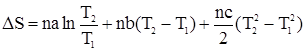 .
.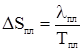 ; (27)
; (27)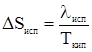 . (28)
. (28)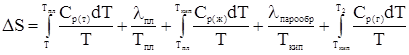 ,
, , (29)
, (29) Дж/град.
Дж/град.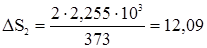 Дж/град.
Дж/град.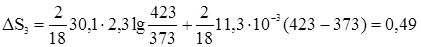 Дж/град.
Дж/град.
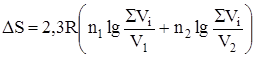 ,
,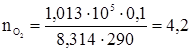 моль,
моль, моль,
моль,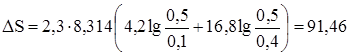 Дж/град.
Дж/град.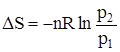
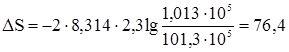 Дж/град.
Дж/град.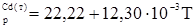 Дж/моль × град;
Дж/моль × град;