
|
|
Следствия из закона Гесса1. Тепловой эффект разложения какого-либо химического соединения равен по абсолютной величине и противоположен по знаку тепловому эффекту его образования. СаСО3 СаО + СО2 DH1 = -DH2. 2. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то при сформулированных выше для количества теплоты условиях, разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния в другое. Пусть протекают две параллельные реакции: С ® А + DH1 С ® В + DH2. Вычтем из первой реакции вторую. С – С ® А – В + DH1 – DH2, следовательно, В ® А + (DH1 – DH2). 3. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое. Пусть протекают параллельные реакции: А ® С + DH1 В ® С + DH2. Вычтем из первой реакции вторую. А – В ® С – С + (DH1 – DH2). И окончательно А ® В + (DH1 – DH2). 4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и сумм теплот образования исходных веществ DHреакции = Так как в процессе реакции все реагирующие вещества и продукты находятся при одинаковых условиях, то при одних и тех же условиях берутся DHi и DHj. В случае расчета теплового эффекта реакции при стандартных условиях расчет упрощается, так как в этом случае для большинства реакций он ведется по справочным данным. DH 5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и сумм теплот сгорания продуктов реакции. DHреакции = Соответственно при стандартных условиях уравнение для расчета принимает вид: DH Задача 1. С учетом известных значений теплот образования участников реакции Fe2O3(т) + 3СО(г) = 2Fe(т) + 3СО2(г) + DHх вычислить ее тепловой эффект при стандартных условиях, если теплоты образования веществ при DH DH DH DH Согласно 4-му следствию из закона Гесса, имеем DHреакции=2DH DHреакции = -27,71 кДж. Задача 2. Зная теплоты сгорания участников реакции при стандартных условиях, вычислить тепловой эффект реакции, приведенной ниже, при С2Н5ОН(ж) + СН3СООН(ж) = СН3СООС2Н5(ж) + Н2О(ж) DH DH DH DH DHреакции = DH DHреакции = 13,5 кДж. Задачи для самостоятельного решения Вычислитьтепловые эффекты химических реакций при стандартных условиях по стандартным теплотам образования* участников процесса.
* стандартные теплоты образования участников процесса взять в справочнике Равдель А.А., Пономарева А.М. Краткий справочник физико-химических величин. Л.: Химия. 1983. 232 с.
Вычислитьтеплоты сгорания этана, этилена, ацетилена, бутадиена-1,4 и бензола при стандартных условиях и сопоставить их со справочными данными. Необходимые величины заимствовать в том же справочнике (см. предыдущую задачу). Закон Гесса широко используется для расчетов величин DH и DU реакций, которые трудно или по существу невозможно провести на практике. С этой целью выбирается некая группа веществ, которые могут превратиться в группы продуктов реакций, проходя различные ряды промежуточных превращений. При этом промежуточные реакции подбираются таким образом, чтобы в их число входила интересующая исследователя реакция, а все остальные были осуществимы экспериментально. В качестве примера рассмотрим следующую задачу. Задача. Найти DH Таким образом, интересующая нас реакция имеет вид: 2Н2(г) + 2С(т) = С2Н4(г); DH1 = х, (1) но провести ее непосредственно не удается. Однако, имеем еще три легко проводимых экспериментально реакций: С(т) + О2(г) = СО2(г); DH2 = -370 кДж/моль (2) Н2(г) + 1/2О2(г) = Н2О(ж); DH3 = -272 кДж/моль (3) С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж); DH4 = -1405 кДж/моль (4) Если просуммировать по две реакции (2) и (3) и вычесть из полученной суммы реакцию (1), то получим реакцию (4). Проверим это. 2С(т) + 2О2(г) + 2Н2(г) + О2(г) - 2Н2(г) - 2С(т) = 2СО2(г) + 2Н2О(ж) - С2Н4(г). Приведя подобные члены, получим: 3О2(г) = 2СО2(г) + 2Н2О(ж) - С2Н4(г) или С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж). Следовательно, 2DH2 + 2DH3 - х = DH4, то есть -2 × 370 - 2 × 272 = DH4 + х -2 × 370 - 2 × 272 + 1405 = х DH1 = 121 кДж/моль. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 СаО + СО2; DH1
СаО + СО2; DH1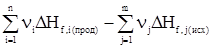 .
.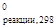 =
= 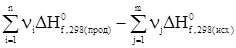 .
.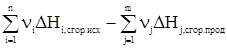 .
.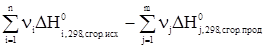 .
. (Fe2O3(т)) = -821,32 кДж/моль;
(Fe2O3(т)) = -821,32 кДж/моль; (C2Н5OH(ж)) = -1366,9 кДж/моль;
(C2Н5OH(ж)) = -1366,9 кДж/моль;