
|
|
Некоторые химические свойства фенола1. Взаимодействие по функциональной гидроксильной группе. 1.1. Образование фенолятов ArOH + NaOH Ar – бензольное ядро. 1.2. Образование простых эфиров алкилированием фенолятов ArONa + RI ® ArOR + NaI ArONa + (CH3O)2SO2 ® ArOCH3 + CH3O–SO2ONa 1.3. Образование сложных эфиров
2. Реакции ароматического ядра 2.1. Галоидирование
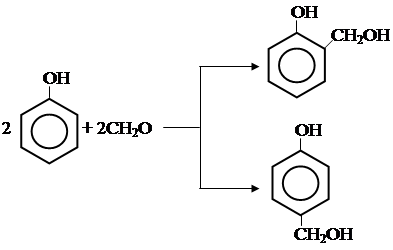
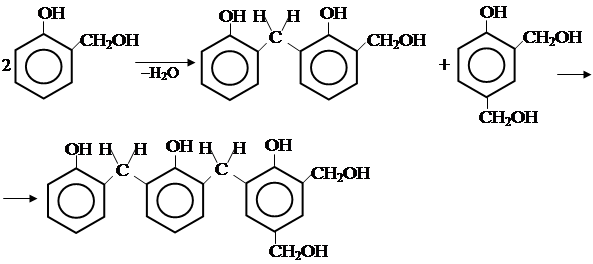
2.2. Сульфирование. Приводит к образованию смеси о- и п-фенолсульфокислот. При высоких температурах (t > 100 °С) доля п-изомера может составлять до 96 %. При снижении температуры увеличивается доля о-изомера и при 20 °С может достигать 49 %. 2.3. Нитрование. Для получения мононитрофенола гидроксибензол нитруют на холоду разбавленной HNO3. Гидроксибензол применяется для многотоннажного получения фенол-формальдегидных и других полимеров, красителей, пластификаторов, ПАВ, использование С6Н5ОН и п-бензилфенола как антисептика. Феноло-формальдегидные смолы – продукты поликонденсации фенола с формальдегидом. Природа продуктов реакции зависит от вида катализатора – кислотного или основного типа и молярного соотношения фенола и формальдегида. При взаимодействии в эквимолярных соотношениях в кислой среде в феноле замещаются атомы водорода в о- и п-положении к ОН – группе и образуются соответствующие изомеры оксибензилового спирта.
Гидроксибензиловые спирты устойчивы только в щелочной среде при низкой температуре. В нейтральной и кислой среде они легко вступают в реакцию поликонденсации.
Рассмотрим некоторые токсикологические характеристики гидроксибензола. По нормативным документам нашей страны фенол – вещество 2-го класса опасности (высокоопасное), выраженный аллерген. Относительная интегральная опасность C6H5OH (А) составляет 537 т/на 1 т СО (опасность СО условно принята за 1). При оценке величины А учитывается относительная опасность присутствия фенола в воздухе, вдыхаемом человеком, вероятность его накопления в окружающей среде и пищевых цепях, действия оксибензола на различные реципиенты, вероятность образования вторичных продуктов. В частности, малеиновой кислоты (НООССНСНСООН), временная допустимая концентрация которой в воздухе рабочей зоны 2,6 мг/м3 и в местах проживания людей 4 × 10-3 мг/м3 (расчет авторов). Для самого фенола эти требования более жесткие. Его ориентировочные предельно-допустимые концентрации в газовой фазе (рабочая зона ~ 0,3 мг/м3), мест постоянного проживания людей ~0,003 мг/м3, в воде рыбохозяйственного назначения Острые отравления фенолом при попадании на кожу наблюдаются при содержании его в атмосфере 8,8 … 12,2 мг/м3. Порог чувствительности lg Рн.п. = A – где t °С; А = 7,6385; В = 1913,8; С = 280. Рассмотрим кратко пути адсорбционного удаления гидроксибензола из промышленных сточных вод двух типов: 1. Концентрированных с Сисх, составляющей до 4 … 5 г/л. 2. Разбавленных с Сисх, равной 20 … 100 мг/л. В первом случае адсорбционное удаление гидроксибензола
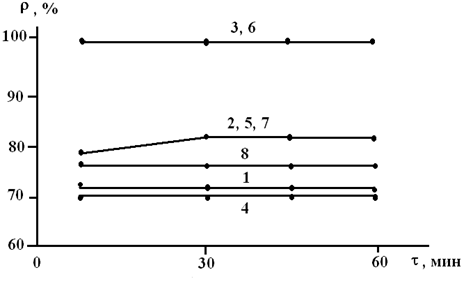
Рис. 17. Влияние продолжительности сорбции, рН исходного раствора и высоты (h) слоя адсорбента 95 %-го концентрата глауконита на глубину извлечения фенола (r). рН: 3 – 1 и 7; 7 – 2, 5, 7 и 8; 10 – 3 и 6; h, см: 10 – 1, 2, 3 и 7; 5, 2 – 4, 5, 6 и 8.
Задачи по теме Задача 1. При полном гидрировании одного из ближайших гомологов бензола образовался циклопарафин с массовой долей водорода в исходном углеводороде – 8,7 %. Написать уравнение реакции. w(С) = 100 - w(Н) = 100 – 8,7 = 91,3 %. Примем, что масса исходного вещества равна 100 г, а его формула имеет вид: СхНу. Тогда имеем: m(C) = 91,3 г; m(H) = 8,7 г. х : у = Формула исходного вещества С7Н8 (С6Н5СН3). Уравнение реакции имеет вид: С6Н5СН3 + 3Н2 = С6Н11СН3. Задача 2. Найти число метильных групп в молекуле ароматического углеводорода, молярная масса которого 106 г/моль. Общая формула такого углеводорода С6H6-k(CH3)k. Откуда имеем: 78 + 14k = 106; k = 2. Формула соединения С6Н4(СН3)2. Это может быть орто-, мета- или пара-ксилол. Задача 3. Найти массу бензола, которая получена из ацетилена, объем которого при 500 °С и давлении 1,013 × 105 Па равен 500 л, если выход целевого продукта составляет 75 %. Уравнение реакции имеет вид: 3С2Н2 = С6Н6, (1) следовательно, можно записать: n(С6Н6) = 1/3n(С2Н2). Объем ацетилена, принявшего участие в реакции, равен: V1(С2Н2) = 0,75; V(С2Н2) = 0,75 × 500 = 375 л. Найдем молярный объем газа в условиях протекания реакции. рVm = RT;
m(С6Н6) = n(С6Н6) × M(С6Н6) = 1/3 n(С2Н2) × M(С6Н6) = Задача 3. При полном сгорании ароматического углеводорода образовалось 5,4 г воды. Определить массу образовавшегося оксида углерода (IV), если массовая доля углерода в углеводороде равна 92,3 %. w(Н) = 100 - w(С) = 100 – 92,3 = 7,7 %. Запишем формулу исходного вещества в виде СхНу. х : у = Простейшая формула соединения СН, а истинная, в связи с тем, что это соединение представляет собой ароматический углеводород, С6Н6. Запишем уравнение реакции: С6Н6 + 7,5О2 = 6СО2 + 3Н2О. n(Н2О) n(СО2) = 2n(Н2О); m(СО2) = n(СО2) × M(СО2) = 2n(Н2О) × M(СО2) = Задача 4. При сгорании бензола и толуола общей массой 17 г образовалось 1,3 моль оксида углерода (IV). Найти количество вещества образовавшегося водяного пара. Запишем уравнения реакции. С6Н6 + 7,5О2 = 6СО2 + 3Н2О (1) С7Н8 + 9О2 = 7СО2 + 4Н2О, (2) из которых следует: n1(СО2) = 6n(С6Н6); n2(СО2) = 7n(С7Н8). Нижний индекс указывает на номер уравнения. Пусть масса бензола в смеси – х, следовательно, масса толуола равна
n1(СО2) + n2(СО2) = 1,3; 6 × 92х + 7 × 78 × 17 – 7 × 78х = 1,3 × 78 × 92
m(C7H8) = 17 – m(C6H6) = 17 – 7,8 = 9,2 г.
n1(H2O) = 3n(C6H6) = 3 × 0,1 = 0,3 моль.
n2(H2O) = 4n(C7H8) = 4 × 0,1 = 0,4 моль. n(H2O) = n1(H2O) + n2(H2O) = 0,3 + 0,4 = 0,7 моль. Задача 5. При нитровании 2,34 г бензола получен нитробензол количеством 0,015 моль. Какова массовая доля бензола, принявшего участие в реакции? Запишем уравнение реакции: С6Н6 + HONO2 = С6Н5NO2 + H2O, из которого следует: n(С6Н6) = n(С6Н5NO2). Количество вещества бензола, направленное на нитрование, равно:
Количество вещества бензола, принявшего участие в реакции: n(С6Н6) = 0,015 моль.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ArO-Na+ + H2O,
ArO-Na+ + H2O,

 ,
,
 =7,6 : 8,7 =
=7,6 : 8,7 = 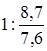 = 1 : 1,14. Ближайшее целочисленное значение х : у = 7 : 8.
= 1 : 1,14. Ближайшее целочисленное значение х : у = 7 : 8. л.
л. моль.
моль. =7,7 : 7,7 =
=7,7 : 7,7 =  моль.
моль. ;
;  ;
; ;
;  ;
;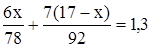
 г.
г. моль.
моль. моль.
моль. моль.
моль. (50 %).
(50 %).