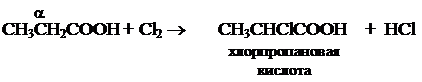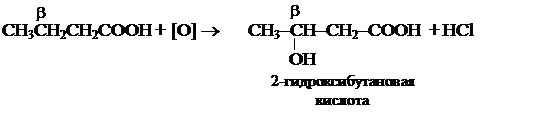|
|
Электронное строение карбоксильной группы
d – дробный заряд в единицах заряда электрона. В силу сдвига электронной пары с ростом d+ ослабляется связь -О-Н, повышается подвижность атома водорода гидроксильной группы и сила кислоты (ее константа электролитической диссоциации, которую часто называют константой кислотности Ка). Ка(НСООН) = 1,77 × 10-4; Ка(СН3СООН) = 1,8 × 10-5; Ка(СН3СН2СООН) = 1,34 × 10-5; Ка(СН3(СН2)2СООН) = 1,52 × 10-5. Таким образом, величина d+ на карбоксильном углероде имеет тенденцию к снижению по мере возрастания длины углеводородного радикала в результате влияния положительного индуктивного эффекта алкильного радикала. Предельные карбоновые кислоты Номенклатура предельных карбоновых кислот.По номенклатуре ИЮПАК: 1. Карбоксильная группа обозначается суффиксом «-овая».
Изомерия одноосновных предельных карбоновых кислот.Для карбоновых кислот возможны все виды изомерии. Кислоты С1 – С3 не имеют изомеров по строению углеродного радикала. Изомерия по положению карбоксильной группы невозможна для моно- и дикарбоновых кислот. Для всех кислот, кроме муравьиной, характерна изомерия по функциональной группе (межклассовым изомером являются сложные эфиры). Физические свойства кислот Рассмотрим некоторые физические свойства ряда СnH2n+1COOH. Низшие представители – подвижные жидкости (обычные условия). Далее, начиная с С5 – маслянистые жидкости, высшие кислоты – твердые вещества
Физические свойства ряда одноосновных кислот приведены ниже (таблица 10). Таблица 10 Физические свойства ряда одноосновных карбоновых кислот
Получение карбоновых кислот Основные методы следующие. 1. Окисление первичных спиртов. 1-я стадия – образование альдегидов. СН3СН2ОН 2-я стадия – получение целевого продукта. CН3СНО 2. Гидролиз нитрилов. R–CºN + 2HOH ® R–COOH + NH3 3. Оксосинтез из непредельных углеводородов. СН3-СН=СН2 + СО + Н2О В процессе оксосинтеза чаще всего молекулы получающихся продуктов содержат на один атом углерода больше, чем исходных веществ. Химические свойства карбоновых кислот 1. Реакции с участиием водорода карбоксильной группы. 1.1. Некоторые кислоты существенно диссоциируют с отщеплением катиона Н+. Н–СООН ⇄ НСОО- + Н+ Как отмечалось ранее, для карбоновых кислот характерны относительно высокие константы диссоциации. Для муравьиной кислоты имеем:
откуда
НСОО- - формиат-ион; СН3СОО- - ацетат-ион. 1.2. Взаимодействие с металлами 2RCOOH + Mg ® (RCOO)2 × Mg + H2 1.3. Взаимодействие со щелочами. RCOOH + NaOH ® RCOONa + H2O 1.4. Взаимодействие с основными оксидами. 2СН3СООН + MgO ® (СН3СОО)2Mg + Н2О 1.5. Взаимодействие с солями более слабых (близких по силе) кислот. 2СН3СООН + Na2CO3 ® 2СН3СООNa + H2CO3 2. Реакции с участием карбоксильной группы.
2.2. Реакции с аммиаком. При смешивании кислоты и аммиака вначале образуется соль аммония, которую затем подвергают сухой перегонке:
Частный случай.
2.4. Димеризация с образованием ангидридов кислот.
3. Реакции с участием водорода a-углеродного атома. 3.1. Галогенирование. Хлорирование, как частный случай галогенирования.
4. Реакции окисления. НСООН + [O] ® HO-COOH ® H2O + CO2

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 2. Атом углерода карбоксильной группы включают в основную цепь и с него начинается нумерация.
2. Атом углерода карбоксильной группы включают в основную цепь и с него начинается нумерация.
 Простейшие представители (НСООН, СН3СООН) хорошо растворимы в воде, смешиваются с ней в любых отношениях, высшие в Н2О не растворяются, первые члены гомологического ряда – обладают резким запахом. Молекулы кислот образуют ассоциаты за счет Н-связей, которые более прочны, чем у спиртов.
Простейшие представители (НСООН, СН3СООН) хорошо растворимы в воде, смешиваются с ней в любых отношениях, высшие в Н2О не растворяются, первые члены гомологического ряда – обладают резким запахом. Молекулы кислот образуют ассоциаты за счет Н-связей, которые более прочны, чем у спиртов.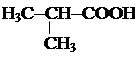

 CН3СНО
CН3СНО CН3СН2СН2СООН
CН3СН2СН2СООН ,
,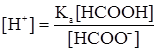
 2.1. Реакции с галогенидами фосфора.
2.1. Реакции с галогенидами фосфора.

 2.3. Реакции со спиртами
2.3. Реакции со спиртами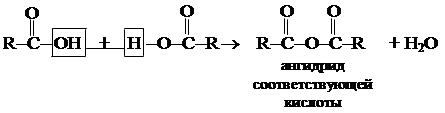
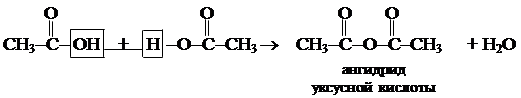 Частный случай:
Частный случай: