
|
|
Свойства отдельных представителей гомологического рядаМуравьиная кислота НСООН содержится в хвое, крапиве, в выделениях муравьев. Это – бесцветная жидкость с резким неприятным запахом. Вызывает ожог кожи, смешивается с водой, эфирами, спиртами в любых отношениях. d = 1,21 г/см3. Уксусная (этановая, метилкарбоновая) кислота СН3СООН. При обычной температуре – бесцветная жидкость с резким запахом. Смешивается с водой, этанолом, диэтиловым и диметиловым эфирами, бензолом в любых отношениях. Нерастворима в CS2. Уксусная эссенция – 70–80 %-ный раствор СН3СООН. Пищевой уксус – 5 %-ный раствор. Тпл = 17 °С, Ткип = 118,1 °С, Уксусный ангидрид. Тпл = -73,1 °С, Ткип = 139,5 °С. Обладает резким запахом, растворим в бензоле, диметиловом эфире, хлороформе. Дипольный момент -2,82 D, H2O -1,84 D. В больших масштабах используется для получения ацетата целлюлозы, фармацевтических препаратов. Задачи по теме Задача 1. Рассчитать массовую долю соли в растворе одноосновной предельной карбоновой кислоты с его исходной массой 200 г и массовой долей водорода в кислоте 8,1 %, если соль получена при поглощении раствором 5,6 л аммиака (условия нормальные). Запишем уравнение реакции. СkH2k+1COOH + NH3 = СkH2k+1COONH4. (1) Установим молекулярную формулу кислоты.
200k + 200 = 113,4k + 372,6; Уточненное уравнение реакции имеет вид: С2H5COOH + NH3 = С2H5COONH4, из которого следует: n(NH3) = n(С2H5COONH4); m(С2H5COONH4) = n(С2H5COONH4) × M(С2H5COONH4) = = n(NH3) × M(С2H5COONH4) =
m(NH3) = n(NH3) × M(NH3) =
m2(раствора) = m1(раствора) + m(NH3); m2(раствора) = 200 + 4,25 = 204,25 г.
Задача 2. При взаимодействии смеси одноосновных карбоновых кислот общей массой 50 г с избытком оксида серебра выделилось 16,8 л газа (условия нормальные). Затем через полученный раствор пропустили избыток аммиака. Найти массу образовавшейся соли, если приведенная массовая доля кислорода в эквимолярной смеси кислот равна 60,4 %. Запишем уравнение реакции взаимодействия исходных веществ с оксидом серебра, учтя, что из предельных одноосновных карбоновых кислот с ним реагирует только муравьиная кислота. НСООН + Ag2O = CO2 + H2O + 2Ag (1) Для остальных СkH2k+1COOH + Ag2O ¹ реакция не идет. (2) С использованием уравнения реакции (1) найдем массу муравьиной кислоты: n(НСООН) = n(CO2); m(НСООН) = n(НСООН) × M(НСООН) = = n(CO2) × M(НСООН) = Найдем молекулярную формулу неизвестной карбоновой кислоты.
6400 = 845,6k + 5556,8; Молекулярная формула кислоты СН3СООН. В результате взаимодействия НСООН с оксидом серебра в растворе остается только уксусная кислота, которая при взаимодействии с избытком аммиака и образует соль по уравнению реакции: СН3СООН+ NH3 = СH3COONH4. (3) m(СН3СООН) = m(смеси) – m(HCOOH) = 50 – 34,5 = 15,5 г. Из уравнения реакции (3) имеем: n(СН3СООН) = n(СH3COONH4); m(СH3COONH4) = n(СH3COONH4) × M(СH3COONH4) =
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ Существуют многочисленные классы азотсодержащих органических соединений. Назовем некоторые из них: нитросоединения, нитрилы, изоцианиды, амины и первым трём дадим лишь самую общую характеристику. Нитросоединения Для гомологического ряда предельных нитросоединений характерна общая формула CnH2n+1NO2 или R-NO2. Приведем некоторые их примеры.
Нитрилы и изоцианиды Общие формулы гомологических рядов этих соединений имеют вид: CnH2n+1-СºN (нитрилы) CnH2n+1-N+ºС- (изоцианиды) Также приведем примеры первых членов их гомологических рядов: CH3-СºN этаннитрил (нитрил уксусной кислоты) CH3-СН2-СºN нитрил пропановой кислоты CH3-СН2-СН2-СºN нитрил бутановой кислоты CH3-N+ºС- метилизоцианид CH3-СН2-N+ºС- этилизоцианид Алифатические амины Теперь перейдем к рассмотрению алифатических аминов, которые охарактеризуем более подробно. Прежде всего, отметим, что подобные амины можно рассматривать как продукты, образующиеся в результате замещения атомов водорода в аммиаке алкильными радикалами. В зависимости от числа подобных радикалов в молекуле различают амины: - первичные R-NH2:
- вторичные , R1 = R2 или R1 ¹ R2:
Например:
Распространение в природе.Соединения с NH2-группой в молекуле широко встречаются в организмах животных и растений. Это – аминокислоты, белки. Низшие амины образуются как продукты разложения белков, присутствуют в отходах жизнедеятельности животных, выделяются при разложении их останков, определяют их запахи. Так, триметиламин обусловливает запах гниющей селедки. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ;
;  ;
; .
. г.
г. г.
г. .
. г.
г. ;
;  ;
; .
. г.
г.




 - третичные , Ri могут быть одинаковыми или разными.
- третичные , Ri могут быть одинаковыми или разными.
 Номенклатура алифатических аминов.По номенклатуре ИЮПАК в названиях аминов, как уже понял внимательный читатель, функциональную группу обозначают суффиксом «-амин» или приставкой «амино-» (соединения I, II, III и IV или изопропиламин ).
Номенклатура алифатических аминов.По номенклатуре ИЮПАК в названиях аминов, как уже понял внимательный читатель, функциональную группу обозначают суффиксом «-амин» или приставкой «амино-» (соединения I, II, III и IV или изопропиламин ).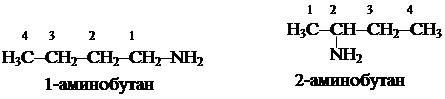 Нумерацию углеродной цепи начинают с того конца, к которому ближе аминогруппа.
Нумерацию углеродной цепи начинают с того конца, к которому ближе аминогруппа.