
|
|
Химические свойства жиров1. Гидролиз.
Если гидролиз протекает в щелочной среде, то продуктами являются соли высших кислот (мыла). Такой гидролиз называют омылением. 2. Реакции присоединения. По двойным связям непредельных кислот, входящих в состав молекул жира, могут присоединять Н2, Br2, I2 и др. Особый интерес представляет процесс гидрирования, используемый в промышленных масштабах для производства маргарина.
3. Полимеризация масел. Растительные масла делятся на три категории: - высыхающие; - полувысыхающие; - невысыхающие. Некоторые масла в тонком слое способны образовать на воздухе эластичные, блестящие, гибкие и прочные пленки, нерастворимые в органических растворителях. На этом свойстве основано использование этих масел для получения лаков и красок. Наиболее часто встречающееся высыхающее масло – льняное. В нем и других подобных продуктах высоко содержание непредельных жирных кислот. Высыхание – процесс окислительной полимеризации. Полувысыхающие масла – подсолнечное, хлопковое, в них меньше непредельных кислот. К невысыхающим маслам относятся оливковое, касторовое и кокосовое. Воски Они содержат преимущественно сложные эфиры высших насыщенных и ненасыщенных карбоновых кислот с преимущественно одноатомными спиртами. Такие вещества содержат четное число атомов углерода (С16 – С36). Воски всегда содержат свободные кислоты, свободные спирты, часто углеводороды и подразделяются на растительные и животные. Примером растительного воска является карнаубский воск, получаемый из листьев бразильской восковой пальмы (карнаубы). Его преимущественный эфир – С25Н51СООС31Н63 можно представить как продукт взаимодействия гексакозановой кислоты С25Н51СООН и мирицилового спирта С31Н63ОН. Карнаубский воск – самый твёрдый и тугоплавкий (температура плавления +83…+91 °С) из восков растительного и животного происхождения. Из-за своих гипоаллергенных и смягчающих свойств, он применяется в качестве ингредиента для многих косметических составов, в медицине, как покрытие лекарственных препаратов в форме таблеток. Ярким представителем животных является спермацет – воск, получаемый из спермацетового масла черепной полости кашалотов. Его преимущественный эфир – С15Н31СООС16Н33 можно представить как продукт взаимодействия пентакарбоновой кислоты С15Н31СООН и гексадецилового спирта С16Н33ОН. Пчелиный воск содержит спирты С24 – С34, этирифицированные (то есть провзаимодействовавшие) с жирными кислотами. Сложные липиды
R1 и R2 – углеводородные радикалы; Х – различные заместители.
Один из составов низкоэрукового рапсового масла:
В его состав входят также фосфолипиды, которые выступают как замедлители атмосферной коррозии стали, эффективные в отсутствии активных стимуляторов процесса (хлорид-ионов и др.). АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ, АРЕНЫ Бензол и его производные
Формула Кекуле (I), однако, не объясняет некоторые свойства бензола, так как он не вступает во многие реакции, характерные для олефинов. Как показали современные методы исследования, атомы в молекуле бензола образуют плоский правильный шестиугольник. Длины связей между ними равны и составляют 0,140 нм. Таким образом, они больше длины двойной связи (0,132 нм), но меньше одинарной (0,154 нм). Все атомы углерода в молекуле бензола находятся в состоянии sp2 -гибридизации. Шесть электронов p-связей образуют единую орбиталь В настоящее время записывают молекулы бензола чаще всего в виде графической формулы (II). С другой стороны, исходя из длины связей в молекуле бензола, которые называют ароматическими или полуторными, их энергия должна была бы занимать промежуточное положение, согласно неравенству: Uдвойная связь < Uбензол < Uодинарная связь. Однако, это не так. Uбензол существенно выше, чем предполагаемая величина, что объясняют наличием единой p-орбитали (рис. 16).
Рис. 16. Схема электронного строения молекулы бензола.
Номенклатура и изомерия производных бензола.Общая формула гомологического ряда ароматических углеводородов бензола СnH2n-6. Ей отвечают структуры (I и II) и формула СН2=СН-СºС-СН=СН2, но гидрирование бензола дает циклогексан, что и решает проблему. Монозамещенные бензола:
не имеют изомеров. Дизамещенные бензола с заместителями существуют в трех изомерных формах.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
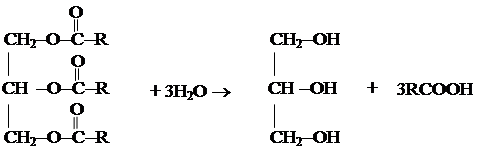
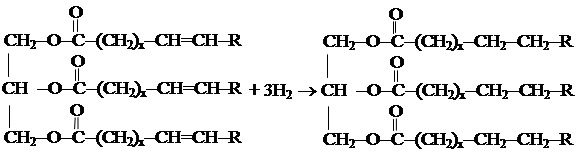
 Фосфатиды – липиды, дающие при гидролизе помимо глицерина и высших монокарбоновых кислот, фосфорную кислоту и аминоспирты.
Фосфатиды – липиды, дающие при гидролизе помимо глицерина и высших монокарбоновых кислот, фосфорную кислоту и аминоспирты. Бензол (С6Н6) – родоначальник ароматических углеводородов. Установить его формулу удалось далеко не сразу. Впервые ее предложил Ф. Кекуле, что сопряжено со множеством легенд. По одной из них Кекуле во сне увидел змею, кусающую собственный хвост. Он решил, что бензол имеет циклическое строение (I).
Бензол (С6Н6) – родоначальник ароматических углеводородов. Установить его формулу удалось далеко не сразу. Впервые ее предложил Ф. Кекуле, что сопряжено со множеством легенд. По одной из них Кекуле во сне увидел змею, кусающую собственный хвост. Он решил, что бензол имеет циклическое строение (I).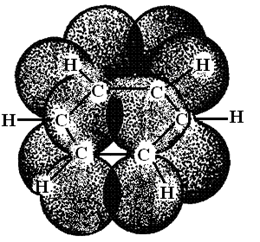


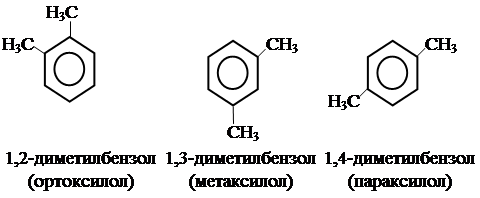

 Тризамещенные бензола с заместителями также существуют в виде трех изомеров.
Тризамещенные бензола с заместителями также существуют в виде трех изомеров.