
|
|
Экологическая характеристикаКритериальные величины ряда спиртов приведены ниже
ПДКс.с.(СН3ОН) = 0,5 мг/м3; ПДКс.с.(С2Н5ОН) = 5 мг/м3.
Метанол – сильный яд, действующий на зрительные нервы и сосуды сетчатки глаза. Критические показатели его определяются по санитарно-токсикологическому действию. 4-й класс опасности, что весьма странно и, вероятно, устарело. Острое отравление сопровождается раздражением слизистой оболочки глаз, верхних дыхательных путей: слезотечение, резь в глазах, першение в горле. Нарастает общая слабость, головная боль, чувство страха. При острых отравлениях выводится из организма в течение 5 – 8 дней, причем на 50 – 70 % через легкие без превращения. Главное противоядие – этанол. При попадании в водоемы окисляется, снижая содержание растворенного кислорода. При С > 4 мг/л уже оказывает влияние на экологическую ситуацию в водоеме, при С > 200 мг/л значительно снижает жизнедеятельность микроорганизмов биологически активного ила при очистке сточных вод. С2Н5ОН при систематическом приеме внутрь действует на печень (церроз), желудочно-кишечный тракт, центральную нервную систему, железы внутренней секреции, снижает уровень тестостерона в крови и снижает половую функцию. У женщин вызывает нарушение менструального цикла, патологическое течение беременности. Этанол оказывает эмбриональное действие: вызывается умственная отсталость детей, врожденные пороки сердца. Метаболизм С2Н5ОН с образованием ацетальдегида протекает в печени за счет окисления ферментом алкогольдегидрогеназой. Этиленгликоль. Основной путь поступления в организм человека – через желудочно-кишечный тракт, где быстро всасывается и сохраняется в течение 10 дней. Спирт высоко токсичен, действует преимущественно на центральную нервную систему, почти всегда вызывает гемолиз эритроцитов. Концентрация в крови ~ 500 мг/л и более характеризует острое отравление. Задачи по теме Задача 1. Устновить формулу предельного одноатомного спирта с массовой долей кислорода 50 %. Общая формула гомологического ряда таких спиртов СkH2k+1OH. Откуда можно записать:
Формула спирта СН3ОН. Задача 2. Какова масса раствора, полученного взаимодействием 4,6 г этилового спирта с 0,23 г металлического натрия? Запишем уравнение реакции: 2С2Н5ОН + 2Na = 2C2H5ONa + H2.
Исходя из неравенства n(H2) = 1/2n(Na); m(H2) = n(H2) × M(H2) = 1/2n(Na) × M(H2) = 0,5 × 0,01 × 2 = 0,02 г. m(раствора) = m(С2Н5ОН) + m(Na) – m(H2) = 4,6 + 0,23 – 0,02 = 4,81 г (спиртовый раствор этилата натрия). Задача 3. При сгорании предельного одноатомного спирта массой 12 г образовалось 14,4 г водяного пара. Напишите уравнение реакции. Уравнение реакции в общем виде запишем следующим образом: СkH2k+1OH +
m(СkH2k+1OH) = n(СkH2k+1OH) × M(СkH2k+1OH) = =
11,2k + 14,4 = 12k + 12; 0,8k = 2,4; k = 3. Уточненное уравнение реакции имеет вид: С3H7OH + Задача 4. Найти массовую долю воды в этаноле (вода является загрязняющим агентом), если при взаимодействии 100 г спирта с металлическим натрием выделилось 0,448 л водорода (объем газа приведен к нормальным условиям). Вода и натрий прореагировали полностью, а образовавшегося количества вещества этилата натрия в 9 раз меньше, чем образовавшегося количества вещества NaOH. Запишем уравнения реакций: 2Na + 2H2O = 2NaOH + H2 (1) 2Na + 2С2Н5ОН = 2С2Н5ОNa + H2. (2) Из уравнений реакций (1) и (2) следует: n1(H2) = 1/2n1(Na); n2(H2) = 1/2n2(Na). Нижний индекс указывает на номер реакции. n(H2) = n1(H2) + n2(H2) =
n1(Na) = n(NaOH); n2(Na) = n(С2Н5ОNa);
Подставим уравнение (4) в уравнение (3).
n(H2O) = n1(Na); m(H2O) = n(H2O) × M(H2O) = n1(Na) × M(H2O) = 3,6 × 10-2 × 18 = 0,648 г.
Задача 5. Какая масса воды образуется при полной дегидратации 18 г предельного одноатомного спирта, плотность которого по воздуху равна 2,07? Молярную массу воздуха принять равной 29 г/моль. M(СkH2k+1OH) = 2,07 × М(воздуха) = 2,07 × 29 = 60 г/моль. 14k + 18 = 60; k = 3. Уравнение реакции дегидратации имеет вид: С3Н7ОН откуда следует: n(С3Н7ОН) = n(H2O). m(H2O) = n(H2O) × M(H2O) = n(С3Н7ОН) × M(H2O) = = Задача 6. Какая масса предельного одноатомного спирта окислилась в результате его взаимодействия с 0,8 г оксида меди (II), если массовая доля водорода в молекуле спирта равна 13,04 %? Общая формула гомологического ряда спиртов, подобных используемому в задаче, - СkH2k+1OH. Из нее следует:
Запишем уравнение реакции С2Н5ОН + CuO = CH3COH + H2O + Cu, из которого имеем: n(С2Н5ОН) = n(Cu); m(С2Н5ОН) = n(С2Н5ОН) × M(С2Н5ОН) = = n(CuO) × M(С2Н5ОН) = 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 ; 16 = 7k +9; k = 1.
; 16 = 7k +9; k = 1.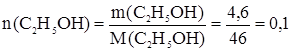 моль;
моль; моль.
моль.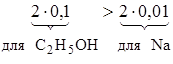 , вытекающего из уравнения реакции и данных задачи, в избытке находится этанол. Считаем по натрию.
, вытекающего из уравнения реакции и данных задачи, в избытке находится этанол. Считаем по натрию. O2 = kCO2 + (k + 1)H2O
O2 = kCO2 + (k + 1)H2O моль.
моль.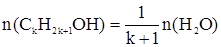
 × M(СkH2k+1OH).
× M(СkH2k+1OH). ; 14k + 18 =
; 14k + 18 = 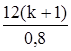 ;
; O2 = 3CO2 + 4H2O.
O2 = 3CO2 + 4H2O. моль.
моль. (3)
(3) (4)
(4) ; 10n1(Na) = 2 × 0,02 × 9 × n1(Na) = 3,6 × 10-2 моль.
; 10n1(Na) = 2 × 0,02 × 9 × n1(Na) = 3,6 × 10-2 моль.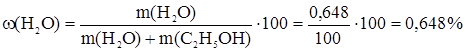
 С3Н6 + Н2О,
С3Н6 + Н2О, г.
г. ; 200k + 200 = 182,6k + 234,7;
; 200k + 200 = 182,6k + 234,7;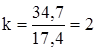 .
. г.
г.