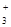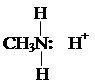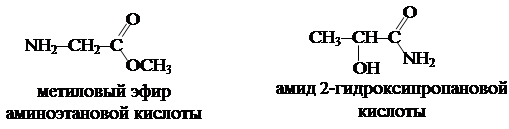|
|
Физические свойства аминовНизшие амины – газы с запахом аммиака. Средние члены гомологического ряда первичных аминов – при обычных условиях жидкости со слабым запахом, высшие – твердые и без запаха. Первые члены гомологического ряда хорошо растворимы в воде, высшие амины – в ней не растворимы. Некоторые физические константы ряда аминов приведены в таблице 11.
Таблица 11 Некоторые физические константы ряда аминов
Получение аминов 1. Каталитическое взаимодействие паров спиртов и NH3. R-OH + NH3 2. Восстановление нитросоединений водородом. R-NO2 + 3H2 3. Взаимодействие NH3 с галогенопроизводными алканов. CH3-I + NH3 ® CH3-NH2 × HI (первая стадия) CH3-NH2 × HI + NH3 ⇄ CH3-NH2 + NH4I (вторая стадия) Химические свойства аминов 1. Кислотно-основные свойства. 1.1. Водные растворы аминов имеют щелочную реакцию за счет связывания протона. НОН ⇄ Н+ + ОН-; CH3-NH2 + H+ ® CH3-NH
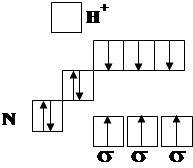
– донорно-акцепторная связь, образуемая благодаря
электронному строению атома азота и иона водорода.
N – 1s22s22p3; Н+ - 1s0 Схема образования катиона такова:
1.2. Взаимодействие с минеральными кислотами. CH3-NH2 + HCl ⇄ [CH3NH3]+Cl- хлорид метиламмония
(CH3)2NH + HCl ⇄ [(CH3)2NH2]+Cl- хлорид диметиламмония
1.3. Проявление очень слабых кислотных свойств. 2(CH3)2NH + 2Na ® 2(CH3)2NNa + H2 диметиламид натрия
2. Взаимодействие с азотистой кислотой R-NH2 + HNO2 ® R-OH + N2 + H2O 3. Алкилирование аминов. CH3I + CH3NH2 ® [(CH3)2NH2]+I- + NH3 ® (CH3)2NH + NH4I Или CH3I + CH3NH2 ® [(CH3)2NH] × НI + NH3 ® (CH3)2NH + NH4I 4. Горение. 4CH3NH2 + 9О2 ® 4СО2 + 2N2 + 10H2O Отдельные представители Метиламин – газ с резким дурным (тошнотворным) запахом, воспринимаемым человеком с концентрации с 0,005 об. %. Образует взрывоопасные смеси с воздухом при содержании 4,95 % (нижний предел) – 0,75 об. % (верхний предел). Ядовит, вызывает угнетение функции дыхания. Кв = 4,25 × 10-4 (сильное основание). Применяется при получении антиспазматических препаратов, красителей антрахинонового ряда, ПАВ. Селективный абсорбент кислых газов. Диметиламин – простейший представитель вторичных аминов, газ с резким запахом, Кв = 5,1 × 10-4 (сильное основание). Хорошо растворим в воде и органических растворителях. Применяется при получении анестезирующих веществ местного действия. На организм действует раздражающе, подобно аммиаку. Триметиламин – бесцветный газ со стойким неприятным запахом, Экологическая характеристика Некоторые токсикологические характеристики предельных алифатических аминов приведены ниже.
* Класс опасности – 2 Задачи по теме Задачи по теме, которые предлагается читателям решить самостоятельно. Задача 1.Вычислить массу метиламина, которая может вступить в реакцию с 3,36 л хлороводорода (н. у.). Задача 2. Какой объем займет при 15 °С и давлении 9,5 × 104 Па азот, образующийся при полном сгорании 40 г диметиламина. Задача 3. Напишите структурные формулы всех третичных аминов состава С5Н13N и назовите их по систематической номенклатуре. Задача 4. Смесь метил- и диметиламина с массовой долей азота в смеси 35 % сожжена в избытке кислорода. Сколько молекул оксида углерода (IV) и воды образуется при сгорании 10 г такой смеси? Задача 5. При сгорании первичного насыщенного алифатического амина, содержащего в молекуле 23,73 % азота, образовалось столько оксида углерода (IV), что из него можно получить 10 г KHCO3. Какая масса соединения сгорела и сколько можно из него получить К2СО3 при 80 %-ном выходе соли? Задача 6. Смесь метиламина и диметиламина с массовой долей азота Задача 7. При сгорании 22,4 л паров амина образовалось 78,4 л водяного пара, было израсходовано 173,6 л кислорода и образовалось 11,2 л азота и столько оксида углерода (IV), что из него можно получить 67,2 л С2Н2. Какой амин сгорел? Написать уравнение реакции горения, используя целочисленные коэффициенты. АМИНОКИСЛОТЫ Аминокислотами называются органические соединения, содержащие в молекуле функциональные группы: амино- и карбоксильную. Номенклатура аминокислот.По систематической номенклатуре названия аминокислот образуются из названий соответствующих карбоновых кислот и добавления слова «амино». Положение аминогруппы указывают цифрами. Отсчет ведется от углерода карбоксильной группы.
Изомерия аминокислот.Их структурная изомерия определяется положением аминогруппы и строением углеродного радикала. В зависимости от положения -NH2-группы различают a-, b- и g-аминокислоты.
Из a-аминокислот строятся молекулы белка. Для них также характерна изомерия функциональной группы (межклассовыми изомерами аминокислот могут быть сложные эфиры аминокислот или амиды гидроксикислот). Например, для 2-аминопропановой кислоты СН3–СН(NH)2–COOH возможны следующие изомеры
Физические свойства α-аминокислот Аминокислоты – бесцветные кристаллические вещества, нелетучие (малое давление насыщенного пара), плавящиеся с разложением при высоких температурах. Большинство их хорошо растворимо в воде и плохо в органических растворителях. Водные растворы одноосновных аминокислот имеют нейтральную реакцию. a-Аминокислоты можно рассматривать как внутренние соли (биполярные ионы): +NH3-CH2-COO-. В кислой среде они ведут себя как катионы, в щелочной – как анионы. Аминокислоты являются амфотерными соединениями, проявляющими одновременно кислотные и основные свойства. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 R-NH2 + H2O
R-NH2 + H2O R-NH2 + 2H2O
R-NH2 + 2H2O