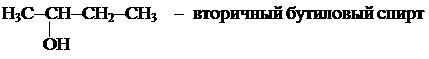|
|
Химические свойства алкинов1. Реакции присоединения. 1.1. Гидрирование. Н3С-СºСН + Н2 Далее Н3С-СН=СН2 + Н2 ® Н3С-СН2-СН3 1.2. Галогенирование. Н3С-СºСН + Br2 ® Н3С-СBr=СНBr 1,2-дибром-1-пропен
Н3С-СBr=СНBr + Br2 ® Н3С-СBr2-СНBr2 1,1,2,2-тетрабромпропан
1.3. Взаимодействие с галогеноводородами. HCºCH + HBr ® H2C=CHBr бромэтен
H2C=CHBr + HBr ® H3C-CHBr2 (по правилу Марковникова) 1.4. Гидратация.
1.5. Взаимодействие со спиртами.
1.6. Присоединение карбоновых кислот
1.7. Димеризация. HCºCH + HCºCH ® HCºC-CН=CH2 винилацетилен Тримеризация. 3HCºCH ® С6Н6 1.8. Образование ацетиленидов металлов. 2HCºCH + 2Na ® 2HCºCNa + H2 HCºCH + NaNH2 ® HCºCNa + NH3 HCºCH + Ag2O 1.9. Взаимодействие с кетонами.
2. Горение (полное окисление). 2С2Н2 + 5О2 ® 4СО2 + 2Н2О Экологическая характеристика В организм человека алкины поступают через легкие, оказывая наркотическое действие, нарастающее с увеличением молярной массы соединений. Длительные контакты с ацетиленом в производственных условиях вызывают функциональные нарушения центральной нервной системы. При высоких концентрациях С2Н2 и пониженном содержании кислорода наблюдается потеря дыхания и отек легких. Величины ПДКi в нормативных документах отсутствуют. Задачи по теме Задача 1. При количественном гидрировании 13 г ацетилена общая масса продуктов взаимодействия увеличилась на 1,3 г. Какие вещества и в каком количестве образовались в процессе гидрирования? Гидрирование ацетилена протекает в две стадии с последовательным образованием этилена (1-я стадия) и этана. Запишем уравнения реакций: С2Н2 + Н2 С2Н4 + Н2 Рассчитаем количества веществ исходных соединений, принявших участие в суммарном процессе:
По отношению к реакции (1) имеем: n1(H2) = n(C2H2) = n1(C2H4) = 0,5 моль. Непрореагировавшее количество вещества водорода, которое примет участие в реакции (2), равно: n2(H2) = n(H2) – n1(H2) = 0,65 – 0,50 = 0,15 моль. Для реакции (2) действительно неравенство:
Следовательно, этилен находится в избытке. Водород прореагирует полностью. Количество вещества оставшегося этилена и образовавшегося этана равны: n2(С2H4) = n1(С2H4) – n2(H2) = 0,50 – 0,15 = 0,35 моль. Одновременно n(С2H6) = n2(H2). Теперь не трудно найти массы этилена и этана, окончательно образовавшихся в процессе протекания последовательных реакций (1) и (2). m(С2H4) = n2(С2H4) × M(С2H4) = 0,35 × 28 = 9,8 г. m(С2H6) = n(С2H6) × M(С2H6) = n2(H2) × M(С2H6) = 0,15 × 30 = 4,5 г. Задача 2. Для получения ацетилена израсходовано 100 л метана. Найти объем полученного ацетилена и суммарный объем (при неизменных условиях протекания реакции) образовавшейся газовой смеси, если метан прореагировал количественно. Запишем уравнение реакции: 2СН4 согласно которого из двух объемов метана образуется один объем ацетилена и четыре объема газовой смеси. Следовательно, имеем:
V(С2Н2 + H2) = 2V(СН4) = 2 × 100 = 200 л. Задача 3. Для получения ацетилена использовано 100 л метана, глубина превращения которого составила 80 %. Определить объемы полученного ацетилена и образовавшейся газовой смеси, приняв неизменными давление и температуру до и после реакции. Запишем уравнение реакции: 2СН4 Объем метана, претерпевший превращение, равен: V1(СН4) = 0,8 × V(СН4) = 0,8 × 100 = 80 л. Согласно уравнения реакции, из двух объемов СН4 образуется один объем С2Н2 и три объема Н2, следовательно: V(С2Н2) = 1/2 V1(СН4) = 1/2 × 80 = 40 л. V(H2) = 3/2 V1(СН4) = 3/2 × 80 = 120 л. Общий объем конечной смеси равен V1(смеси) = 20 л + 40 л + 120 л = 180 л. ПРЕДЕЛЬНЫЕ СПИРТЫ Спирты (алкоголи) – органические соединения, которые содержат в молекуле одну или несколько гидроксильных групп, связанных непосредственно с углеводородным радикалом. Ранее отмечалось, что их нужно рассматривать как производные алканов, в которых атомы водорода заменены группами ОН. Общая формула гомологического ряда подобных предельных одноатомных спиртов – СnH2n+1OH, многоатомных – СnH2n+2-m(OH)m, где m – атомность спирта. Спирты, в том числе и одноатомные, делятся на первичные, вторичные и третичные. Из приведенных ниже примеров легко понять основы такой классификации. Н3С-СН2-СН2-СН2-ОН - первичный бутиловый спирт, в котором гидроксильная группа связана с первичным углеродным атомом.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
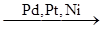 Н3С-СН=СН2.
Н3С-СН=СН2.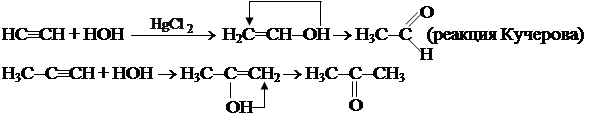
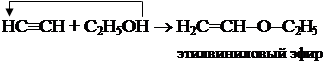

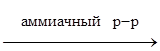 AgCºCAg + H2O
AgCºCAg + H2O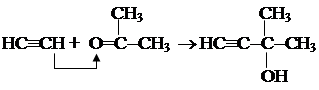
 С2Н4 (1)
С2Н4 (1)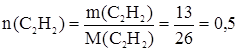 моль;
моль;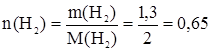 моль.
моль. и, следовательно, молекулярный водород находится в избытке. Ацетилен полностью прореагирует в реакции (1). Это позволяет оценить количество вещества прореагировавшего водорода и полученного этилена.
и, следовательно, молекулярный водород находится в избытке. Ацетилен полностью прореагирует в реакции (1). Это позволяет оценить количество вещества прореагировавшего водорода и полученного этилена. .
. С2Н2 + 3Н2,
С2Н2 + 3Н2, л,
л,