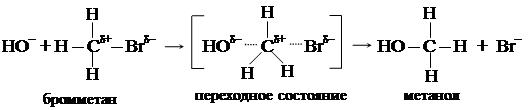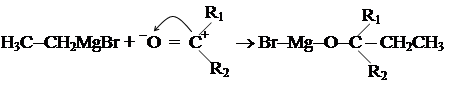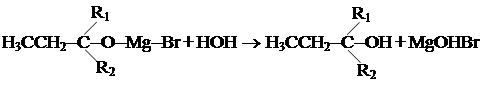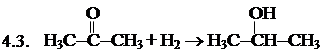|
|
Получение одноатомных спиртов
Гидролиз галогеналкилов является реакцией нуклеофильного замещения, рассмотрим механизм реакции При нуклеофильном замещении молекула нуклеофила атакует тот атом углерода молекулы субстрата, на котором сосредоточен частичный положительный заряд (образующийся, например, в результате действия отрицательного индуктивного эффекта заместителя). Электроны разрывающейся связи уходят вместе с освобождающимся ионом, электронную пару для образования новой связи предоставляет нуклеофил. Рассмотрим этот тип реакций на примере реакции гидролиза галогенпроизводных. При действии свежеприготовленного гидрооксида серебра или даже воды (особенно в присутствии щелочей) галогеналкилы дают спирты: C2H5I + AgOH ® С2Н5 – ОН + AgI¯ йодэтан гидроксид серебра этанол йодид серебра
С2Н5 – I + HОН ⇄ С2Н5 – ОН + HI йодэтан вода этанол йодоводород
Вторая реакция обратима. Для того чтобы реакция шла в сторону образования спирта, необходимо брать большой избыток воды и связывать образующуюся галогеноводородную кислоту едким натром и другими щелочными агентами: СН3СН2I + NaОН ® СН3СН2ОН + NaI йодэтан гидроксид натрия этанол йодид натрия
Эта реакция протекает по механизму нуклеофильного замещения. Первичные алкилгалогениды легче всего гидролизуются по механизму бимолекулярного нуклеофильного замещения (SN2), третичные алкилгалогениды – по механизму мономолекулярного нуклеофильного замещения (SN1). Вторичные галогенпроизводные могут реагировать и по механизму SN2 и по механизму SN1 в зависимости от условий реакции (полярность растворителя, температура и т.д.). Если реакция протекает по механизму SN2, отрицательно заряженная гидроксильная группа атакует положительно заряженный атом углерода со стороны, противоположной отрицательно заряженному атому галогена. При наличии достаточной энергии гидроксил приближается настолько, что между ним и атомом углерода начинает образовываться связь, а энергия взаимодействия между атомами углерода и галогена резко снижается и связь рвется.
В этом переходном состоянии атом углерода и все три водородных атома находятся в одной плоскости (плоская молекула). Затем анион галогена выталкивается и образуется молекула спирта. Образование переходного состояния является самой медленной стадией, определяющей скорость всей реакции. Поскольку в образовании переходного состояния принимают участие оба реагента, ее скорость зависит от концентрации как галогена, так и нуклеофила (иона гидроксила). Стереохимический результат реакции SN2 хорошо иллюстрируется применением оптически активных субстратов, в которых атом галогена связан с асимметрическим атомом углерода. Как правило, реакции SN2 таких соединений протекают стереоспецифично со 100 %-ным обращением конфигурации (инверсия или вальденовское обращение). Например, R-2-хлорбутан в ходе щелочного гидролиза даёт S-2-бутанол. У третичных алкилгалогенидов подход отрицательно заряженной частицы стерически затруднен имеющимися объемными заместителями и процесс идет по другому механизму – SN1. В очень малой степени, но все же происходит процесс диссоциации третичного бромистого бутила с образованием карбкатиона: (CH3)3C – Br ⇄ (CH3)3C+ + Br – (очень медленно) 2-бром-2-метилпропан карбкатион
Образующийся карбкатион мгновенно реагирует с находящимися в растворе нуклеофильными частицами: (CH3)3C+ + HO– ® (CH3)3C – OH (очень быстро) В этом случае скорость реакции зависит только от степени диссоциации и, следовательно, от концентрации в реакционной смеси субстрата, т.е. взаимодействие является реакцией нуклеофильного замещения первого порядка. Реакции SN1 оптически активных галогенпроизводных, как правило, протекают с образованием рацемической смеси (эквимольной смеси энантиомеров с соотношением чисел молекул 1 : 1), т.к. образующийся катион атакуется нуклеофилом равновероятно с обеих сторон. 2. Взаимодействием альдегидов и кетонов с металлорганическими (магнийорганическими) соединениями.
R в R-MgBr ведет себя как нуклеофильная частица. Далее протекает процесс гидролиза:
3. Гидратация этиленовых углеводородов. Н2С=СН2 + НОН ® Н3С-СН2ОН 4. Каталитическое восстановление альдегидов, кетонов и сложных эфиров (катализаторы – Ni, Cu, Co, Pt, Pd).
5. Из природного растительного сырья, содержащего крахмал, посредством брожения: крахмал ® nC12H22O11 ® 2nC6H12O6 ® 4nC2H5OH + 4nCO2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
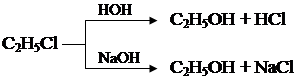 1. Гидролиз галогеналкилов при нагревании с водой или водными растворами щелочей (щелочной гидролиз).
1. Гидролиз галогеналкилов при нагревании с водой или водными растворами щелочей (щелочной гидролиз).