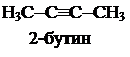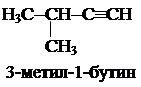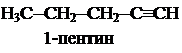|
|
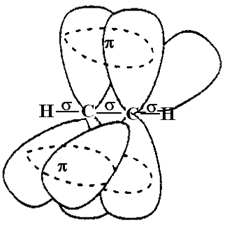
Алкины (ацетиленовые углеводороды)Алкины содержат в молекуле тройную связь, состоящую из одной s- и двух p-связей. Формула гомологического ряда CnH2n-2. Простейший представитель – ацетилен С2Н2. Атомы углерода тройной связи находятся в состоянии sp -гибридизации (2 орбитали). Такая связь прочнее двойной. Рассмотрим вопрос энергетики двойных и тройных связей более подробно. Обозначим через Ui – энергию i-той связи. UС–С(алканы) = 331,8 кДж/моль, UС=С(олефины) = 587,9 кДж/моль. Если принять, что связи аддитивны, то есть не оказывают влияния друг на друга, то из разности UС=С – UС–С легко получить величину В то же время, UСºС(ацетиленовые) = 830,0 кДж/моль. Тогда из тех же соображений Up-связи = (830,0 – 331,8)/2 = 249,1 кДж/моль. Следовательно, вторая p-связь алкинов несколько ослабляет первую, хотя, в целом, конечно, они равноценны. Таким образом, усредненная величина энергии p-связей в алкинах меньше и они менее прочны, чем в алкенах. Свойства тройной связи: – атомы углерода, связанные тройной связью, имеют электроотрицательность = 2,75; – длина СºС-связи = 0,120 нм; – валентные углы в ацетилене на основании этой модели равны 180° и молекула имеет линейную конфигурацию, что делает невозможной цис-транс-изомерию при тройной связи; – связь сильно поляризована, т.к. в sр- гибридной форме углеродный атом сильнее удерживает электроны, чем в sр2 и sр3 - гибридных формах; следовательно; электронная пара СН-связи в молекуле ацетилена ближе к ядру С, чем в случае этилена, атом Н более подвижен, обладает слабыми кислотными свойствами (в отличие от алканов и алкенов). Электронное строение молекулы ацетилена, для которой характерна sp -гибридизация, показано на рис. 13.
Рис. 13. Электронное строение молекулы ацетилена. Изомерия алкинов.Для алкинов возможны два вида структурной изомерии: – изомерия строения углеродной цепи; – изомерия положения тройной связи. Первые два гомолога: НСºСН этин (ацетилен) и Н3С-СºСН аллилен (пропилен, пропин) не имеют изомеров.
Пример изомерии строения углеродной цепи.
Номенклатура алкинов.По систематической номенклатуре алкины называют, заменяя в названии суффикс «ан» на «ин» (пропан ® пропин). Главная цепь должна обязательно включать тройную связь. Цепь нумеруют с конца, более близкого к тройной связи. Н3С-СºС-СН3 2-бутин н-С3Н7-СºСН 1-пентин СН3-СºС-С2Н5 2-пентин Методы получения алкинов 1. Действие спиртового раствора щелочи на дигалогенпроизводные и галогенпроизводные. 1.1. СН2Br-CH2Br ® CHºCH + 2HBr 1.2. СН3-СН2-СНCl2 ® СН3-СºСН + 2HCl 2. Присоединение алкила к ацетилениду натрия или магния. Первая стадия. НСºСН + NaNH2 ® HCºCNa + NH3 амид натрия ацетиленид натрия Вторая стадия. HCºCNa + CH3I ® CHºC-CH3 + NaI Частные реакции. 3. Высокотемпературный крекинг метана. 2СН4 ® CHºCH + 3Н2 (1400 0С) 4. Гидролиз карбида кальция. CaC2 + 2H2O ® CHºCH + Ca(OH)2 Физические свойства алкинов Соединения С2 - С4 – газы, С5 – С15 – жидкости, С16 и тяжелее – твердые вещества при стандартных условиях. Первый член гомологического ряда С2Н2 – газ без запаха, цвета и вкуса, плохо растворим в воде (1,15 объема в Некоторые физические свойства ряда алкинов приведены в таблице 6. Таблица 6 Некоторые физические свойства ряда алкинов 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Для С4Н6 возможны два изомера по положению тройной связи:
Для С4Н6 возможны два изомера по положению тройной связи: