
|
|
Получение олефиновых углеводородовВ природе соединения этого класса встречается не часто. Сравнительно велико их присутствие в нефтях Канады, из них и ряда других выделены соединения от С6Н12 до С13Н26. Синтетические методы следующие. 1. Первые четыре члена гомологического ряда получают крекингом алканов. Процесс связан с разрывом С-С – связей при высоких температурах С7Н16 2. Дегидрогенизация предельных углеводородов
3. Дегалогенирование дигалогенпроизводных СН3-СНBr-СНBr-СН3 + Zn ® СН3-СН=СН-СН3 + ZnBr2 4. Дегидрогалогенирование (горячим спиртовым раствором щелочи) СН3-СНBr-СH3 + KOH На примере реакции дегидрогалогенирования рассмотрим механизм реакции элиминирования. Вообще реакции элиминирования классифицируются по признаку относительного расположения центров, от которых отщепляются группы: 1,1-, 1,2-, 1,3- элиминирование. В реакции 1,1-элиминирования (a-элиминирования) обе группы отщепляются от одного и того же атома, в результате образуются карбены: СHCl3 ® :CCl2 + НCl хлороформ дихлоркарбен хлороводород
Однако карбены не являются конечными продуктами реакции, поскольку они очень реакционноспособны. Первоначально образующийся карбен может перегруппировываться или димеризоваться в более стабильное вещество. 1,3- или g-элиминирование, так же как и элиминирование от более удалённых центров, обычно даёт циклические продукты; но чем удалённее центры, тем сложнее осуществить элиминирование из-за снижения вероятности встречи реакционных центров. Наиболее обычный из типов этой реакции – 1,2- или b-элиминирование, в этом случае отщепляются группы, связанные с соседними атомами углерода и реакция приводит к образованию двойной и тройной связи: СН3 – СН2 – СН2ОН 1-пропанол пропен вода
Реакция элиминирования может быть мономолекулярной (Е1) или бимолекулярной (Е2). Перейдём к реакции дегидрогалогенирования галогеналканов. Третичные галогеналканы при нагревании и поляризующем воздействии диполей растворителя медленно подвергаются слабой ионизации. Образующийся при этом карбкатион быстро выталкивает протон, захватываемый присутствующим в среде основанием – гидроксид- или алкоксид-ионом (НО– или RO–). Самая медленная стадия реакции (образование карбкатиона) не зависит от реагента, поэтому реакцию называют мономолекулярной (E1):
Механизм E1характерен для третичных галогеналканов. У этих соединений связь С–Hal более полярна по сравнению со вторичными и первичными замещенными, и ионизация протекает легче. Но основная причина состоит в том, что образующийся третичный карбкатион более устойчив, чем вторичный или первичный. Стабилизация карбкатиона (компенсация положительного заряда) является следствием действия положительного индукционного эффекта алкильных радикалов вокруг третичного атома углерода, а также благодаря перекрыванию свободной р-орбитали С-атома с s-орбиталями соседних С–Н – связей (эффект сверхсопряжения). Чем больше таких связей по соседству, тем более скомпенсирован заряд.
Гидроксид (алкоксид-)-ион атакует в молекуле галогеналкана водород, находящийся у соседнего с галогеном атомом углерода. Последовательное перемещение электронов s-связей от гидроксид-иона в сторону галогена разрыхляет связи С–Н и С–Вr, и в возникающем переходном состояниипроисходит их синхронный разрыв. Освобождающаяся электронная пара связи С–Н образует двойную связь. Реакция элиминирования протекает в соответствии с правилом Зайцева:при дегидрогалогенировании водород отщепляется предпочтительно от соседнего, наименее гидрогенизированного атома углерода:
5. Очень распространено получение олефиновых углеводородов дегидратацией спиртов СН3-СН2ОH Порядок отщепления молекулы воды также определяется правилом Зайцева: наиболее легко отщепляется атом водорода от соседнего наименее гидрогенизированного атома углерода, соединенного с гидроксильной группой.
Третичные спирты дегидратируются наиболее легко. 6. Частичное гидрирование ацетиленовых углеводородов (о них речь впереди) НСºСН + Н2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 С4Н10 + СН3-СН=СН2
С4Н10 + СН3-СН=СН2
 СН3-СН=СН2 + KBr + H2O
СН3-СН=СН2 + KBr + H2O СН3–СН2=СН2 + Н2О
СН3–СН2=СН2 + Н2О
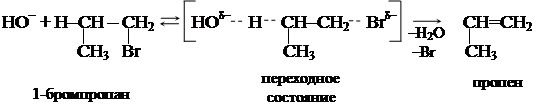 Для первичных галогеналканов характерен бимолекулярный механизм элиминирования (Е2),при котором в решающей стадии реакции участвуют два вещества: галогеналкан и реагент-основание (спиртовой раствор щелочи):
Для первичных галогеналканов характерен бимолекулярный механизм элиминирования (Е2),при котором в решающей стадии реакции участвуют два вещества: галогеналкан и реагент-основание (спиртовой раствор щелочи):
 Н2С=СН2 + Н2О
Н2С=СН2 + Н2О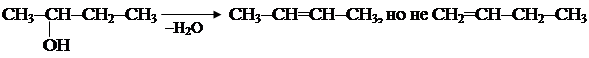
 Н2С=СН2
Н2С=СН2