
|
|
Физические свойства циклоалкановОб устойчивости циклов, рассматривая термодинамическую сторону вопроса, в первом приближении, можно судить по удельным теплотам сгорания, рассчитанным на одну метиленовую группу (таблица 3). Таблица 3 Изменение (избыток) теплот сгорания (кДж) циклоалканов в расчете на метиленовую группу (по сравнению с циклогексаном)
Температура плавления и кипения ряда нормальных циклоалканов приведены в таблице 4.
Таблица 4 Физические константы ряда нормальных алканов
Получение циклоалканов В целом, они подобны свойствам обычных алканов – это трудноокисляемые и малореакционноспособные соединения. Получение малых циклов (С3Н6 и С4Н8) 1. Действие металлического натрия на 1,3-дигалогенопроизводные (внутримолекулярная реакция Вюрца).
2. Гидрирование ароматических углеводородов
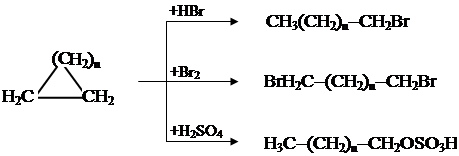
С другими способами получения циклоалканов можно познакомиться в специальной литературе. Химические свойства малых циклов За счет высокого напряжения связей циклопропан и циклобутан легко вступают в реакции, идущие с разрывом цикла. 1. Реакции гидрирования.
2. Взаимодействие с галогеноводородами, галогенами, сильными минеральными кислотами.
n = 1 и 2 3. При действии хлора наряду с разрывом цикла протекает реакция замещения
4. Гидрирование изопропилциклопропана протекает по реакции:
Химические свойства средних циклоалканов похожи на свойства алканов. Исключением является реакция дегидрирования циклов С6, у молекул которых оотщепляются сразу шесть атомов водорода.
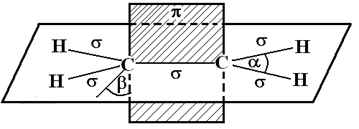
Применение циклоалканов Синтетические и природные, входящие в состав эфирных масел, циклические соединения широко применяются в парфюмерии. Некоторые характеризуются высокой физиологической активностью. Например, циклопропан – анестетик (от слова «анестезия») общего действия, широко применяемый при любых хирургических операциях, так как совершенно безвреден для человеческого организма. Анестезия с его использованием протекает без неприятных последствий. Экологическая оценка Экологическая характеристика соединений этого класса изучена слабо. Отметим лишь, что минимальная концентрация, ведущая к боковому положению белых мышей с последующим летальным исходом составляет: для циклопропана – 110 мг/л; для метилциклопропана – 95-120 мг/л; для этилциклопропана – 35 мг/л. Таким образом, она сопоставима со значениями для н-предельных углеводородов. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Алкены (олефины) Представители этого класса химических соединений, называемых также этиленовыми углеводородами, содержат в молекуле одну двойную связь, в связи с чем, формула их гомологического ряда имеет вид СnH2n, то есть тождественна таковой для циклоалканов. Так как соединение c n = 1 СН2 (метилен) не существует в силу чрезвычайно высокой химической активности, это привело к двум обстоятельствам: - вызвало появление представлений о существовании двойной связи в органических соединениях; - к существованию этилена, С2Н4, как первого члена соответствующего гомологического ряда. Ранее отмечалось, что в органических соединениях атом углерода находится в возбужденном состоянии и возможен процесс sp3 -гибридизации. Однако, если появляется двойная связь, гибридизации подвергаются лишь две из трех р-орбиталей. Хорошо известно, что такой тип называется sp2 -гибридизацией, что приводит к образованию атомом углерода трех s-связей в органических соединениях с углами между ними 120°, находящимися в одной плоскости. Оставшиеся негибридизованными р-орбитали двух взаимодействующих атомов, точнее находящиеся на них валентные электроны образуют p-связь. Как читателям уже известно, эта связь располагается под углом в 90° к линии, соединяющей центры взаимодействующих атомов (рис. 11). Угол a равен 120°, b - 90°.
Рис. 11. Схематическое расположение связей в молекуле этилена.
p-связь не является сферически симметричной и не позволяет образующим ее атомам вращаться относительно линии, соединяющей их центры. Вместе с тем, образующие ее электроны более доступны для внешних воздействий, а энергия этой связи (256,1 кДж/моль) ниже энергии s-связи, образуемой атомами углерода (331,8 кДж/моль). Следовательно, олефины более реакционноспособны, чем алканы, а их химические свойства, в числе прочих, несомненно связаны с разрывом p-связи. Другой характеристикой p-связи является ее высокая поляризуемость, ведущая к способности приобретать дополнительный заряд под воздействием внешнего электрического поля. В силу этого алкены способны к разрыву С–С-связи не только по радикальному, но и по ионному механизму. Таким образом, можно сформулировать основные отличия двойной связи от одинарной: – расстояние между атомами углерода при двойной связи меньше, чем при одинарной (0,134 нм); угол между гибридными атомными 120°; – электроотрицательность sp2 -гибридизованного атома С = 2,69, это выше, чем у sp3 -гибридизованного атома С; – затрудненное вращение вокруг линии, соединяющей атомы С; – двойная связь более прочна, т.к. увеличивается электронная плотность на связывающих молекулярных орбиталях между атомами углерода (термическая стойкость этилена выше, чем этана); – высокая реакционная способность p-связи, что объясняется большей подвижностью электронов вне плоскости молекулы; – повышенная электронная плотность по сравнению с одинарной связью, причем на периферии молекулы. Это приводит к тому, что к двойной связи притягиваются положительно заряженные ионы или полярные молекулы своим положительным полюсом. Номенклатура олефинов.Этиленовые углеводороды называют по тривиальной номенклатуре, добавляя, как указывалось ранее, к названию радикала соответствующего углеводорода окончание «ен» (этилен, пропилен). При использовании систематической номенклатуры (алгоритм): 1. Выбирается главная цепь, которая обязательно должна включать двойную связь, что обозначается тем же суффиксом «ен». 2. В названии допустимо указывать положение двойной связи как перед (1-бутен), так и после суффикса (бутен-1). Однако в последние годы чаще используется первый вариант; считается, что так удобнее склонять названия. 3. Нумерация цепи начинается с того конца, к которому ближе двойная связь.
Изомерия олефиновых углеводородов.Для соединений этого класса возможно 2 типа структурной изомерии и пространственная геометрическая изомерия.
2. Изомерия по положению двойной связи.
3. Геометрическая изомерия.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|



 )
)




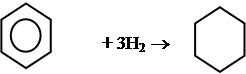
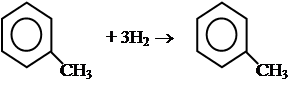
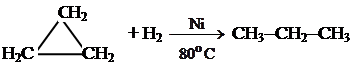
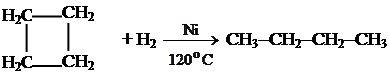
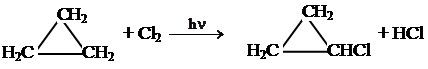
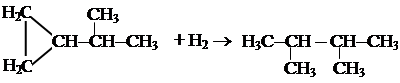
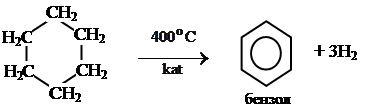
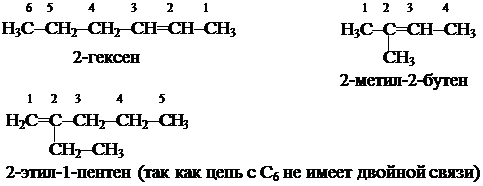
 1. Изомерия строения углеродного скелета.
1. Изомерия строения углеродного скелета.