|
|
Некоторые отдельные представителиСН4. Бесцветный газ, без запаха с Ркрит = 45,8 атм, tкрит = -82,5 °С. В С2Н6. Бесцветный газ, без запаха. В 100 мл Н2О растворяется 4,7 мл изо-С5Н12. Имеет два изомерных углеводорода: 2-метилбутан СН3СН(СН3)СН2СН3 и 2,2-диметилпропан – бесцветные, подвижные, легколетучие жидкости. 2-метилбутан: tкип = 27,8 °С, tпл = -159,9 °С; 2,2-диметил-пропан: tкип = 9,5 °С, tпл = -16,6 °С.
Прозрачная бесцветная жидкость с запахом бензина. Технически чистый и-октан имеет октановое число 98…100, технический – 92…97. Антидетонационные свойства и-октана приняты за 100 единиц по октановой шкале, характеризующие устойчивость топлива к детонации. Вазелин – полужидкая смесь жидких и твердых углеводородов с Парафин представляет собой смесь твердых углеводородов – продукт переработки нефти и сухой перегонки бурого угля и торфа. Экологическая характеристика алканов По отношению к человеку лканы оказывают сильное наркотическое действие. Однако, в силу их сравнительно малой растворимости в воде, в связи с чем для создания токсической концентрации в крови требуются очень высокие содержания их в воздухе. Низшие алканы в обычных условиях физиологически малоактивны. Но, начиная с nC порядка 5 или 6, они способны оказывать раздражающее действие на дыхательные пути. Высшие предельные углеводороды более опасны при попадании на кожу. Нормальные алканы более легко проходят через ткани, чем разветвленные, с ростом их молярной массы проницаемость возрастает. Разветвленные алканы в организме человека не задерживаются, нормальные – окисляются с образованием соответствующих кислот. Наркотические и смертельные концент рации паров ряда предельных углеводородов, мг/л для белых мышей приведены ниже:
ПДКр.з. предельных углеводородов с С1–С10 порядка 300 мг/м3. ПДКм.р.(н–С6Н14)=60мг/м3; ПДКм.р.(н–С5Н12)=100мг/м3; ПДКм.р.(н–С4Н10)=200 мг/м3. В качестве защиты при невысоких концентрациях в воздухе предельных углеводородов пригоден фильтрующий противогаз марки А. При высоких – изолирующие шланговые противогазы ПШ-1, ПШ-2. Приведем решение некоторых задач с участием алканов. Задачи по теме Задача 1. Какова масса соединений, образующихся при взаимодействии 106,5 г хлора и 16 г метана? Процесс взаимодействия рассмотрим следующим образом. Вначале протекает реакция CH4 + Cl2 ® CH3Cl + HCl (1) В этом и в других случаях для расчетов сообразно определить количества моль участвующих в реакции веществ. Это позволит оценить, участвуют они в эквивалентных количествах или имеется избыток одного из реагентов. Отметим, что для любой реакции, записанной в общем виде аА + вВ ® сС, находящееся в избытке вещество определяется из неравенства: если в×n(A) > a×n(B), то в избытке реагент А, в обратном случае – В.
Для записанной выше 1-й реакции требуемое соотношение участников имеет вид: n1(CH4) = n1(Cl2) = n1(CH3Cl) = n1(HCl). Тогда n1(HCl) = 1,0 моль, а из соотношения 1×1,5 > 1×1 следует, что хлор взят в избытке. Если бы в избытке находился CH4, то с завершением реакции (1) процесс взаимодействия метана и хлора прекратился, так как CH4 не взаимодействует с образующимися продуктами реакции. В данном случае этого не происходит, так как избыток хлора далее вступает в реакцию с образующимся хлорметаном по схеме: CH3Cl + Cl2 ® CH2Cl2 + HCl (2) Для реакции (2) n2(CH2Cl2) = n2(HCl) = n2(Cl2) = Dn(Cl2). Избыток хлора, оставшийся после реакции (1), равен: Dn(Cl2) = n1(Cl2) - n1(CH4) = 1,5 – 1,0 = 0,5 моль; n1(CH3Cl) = 1,0 моль. Из неравенства 1×1 > 1×0,5, записанного для реакции (2), следует, что в избытке находится хлорметан, который реагирует не полностью. Оставшееся после завершения реакции (2) количество вещества хлорметана и его масса равны: Dn(CH3Cl) = n1(CH3Cl) – Dn(Cl2) =1,0 – 0,5 = 0,5 моль m(CH3Cl) = Dn(CH3Cl)×M(CH3Cl) = 0,5 × 50,5 = 25,25 г. n2(HCl) = Dn(Cl2) = 0,5 моль; n(HCl) = n1(HCl) + n2(HCl); n(HCl) = 1,0 + 0,5 = 1,5 моль m(HCl) = n(HCl) × M(HCl) = 1,5 × 36,5 = 54,75 г. Масса образовавшегося дихлорметана равна: m(CH2Cl2) = n(CH2Cl2) × M(CH2Cl2); n(CH2Cl2) = Dn(Cl2); m(CH2Cl2) = Dn(Cl2) × M(CH2Cl2) = 0,5 × 85 = 42,5 г. В связи с избытком CH3Cl применительно только к исходным веществам реакция (2) дальше не пойдет. Следовательно, количества вещества и массы участников реакции далее меняться не будут. Задача 2. Каков объем сгоревшего алкана, в молекуле которого соотношение масс углерода и водорода равно 4,5, если в процессе реакции образовалось 3,36 л оксида углерода (IV)? Принять, что температура и давление в процессе протекания реакции постоянны. Общая формула гомологического ряда алкановых углеводородов СnH2n+2, откуда имеем:
Следовательно, молекулярная формула алкана С3Н8. Запишем уравнение реакции С3Н8 + 5О2 ® 3СО2 + 4Н2О, из которого следует, что на образование трех объемов СО2 расходуется один объем С3Н8. Тогда можно записать:
Задача 3. При нагревании метана без доступа воздуха получено 96 г сажи с выходом по реакции 80 %. Каковы объемы поданного на термическую диссоциацию и полученного в результате реакции газов в расчете на нормальные условия? Запишем уравнение реакции: СН4
Исходя из уравнения реакции, имеем: n(C) = n(CH4) и n(H2) = 2n(C). Тогда: V(H2) = n(H2) × Vm; V(H2) = 2 × 8 × 22,4 = 358,4 л. Vm – молярный объем газов при условии реакции V(CH4) = n(CH4) × Vm/0,8 = n(C) × Vm/0,8; V(CH4) = 8 × 22,4/0,8; V(CH4) = 224 л. Циклоалканы Циклоалканы – предельные углеводороды, атомы которых замкнуты в цикл, с общей формулой гомологического ряда СnH2n. Первый член ряда – циклопропан (С3Н6). Различают малые циклы (Сn – 3…4), средние (Сn – 5…7) и макроциклы (Сn ³ 8). Каждый атом углерода находится в состоянии sp3 – гибридизации и, следовательно, образует 4 одинарные s-связи.
Номенклатура циклоалканов.Такие соединения называют еще алициклическими, под которыми понимают все карбоциклические соединения, включающие циклы углеродных атомов за исключением ароматических соединений (имеющих бензольное кольцо).
Строение циклоалканов.Первоначально считалось, что все атомы цикла расположены в одной плоскости. Тогда должны быть следующими углы между связями: 3-х членный цикл – 60°, 4-х членный – 90°, 5-ти членный – 108°, 6-ти членный – 120°. Вместе с тем, для цепей предельных углеродных атомов в отсутствии их возбуждения характерны так называемые тетраэдрические углы – 109°28¢. Была высказана идея (Байер, 1885 г), что с ростом отклонения угла между С–С-связями от тетраэдрического растет напряженность и снижается устойчивость соединений, то есть повышается их химическая активность. За меру подобной напряженности цикла была предложена половина разности (109°28¢ - фактический валентный угол)/2, которую обозначим через a. Ниже показано, как величина a связана с Сn в цикле:
Таким образом, меньше всего напряжена молекула циклопентана, а наиболее – циклопропана. Действительно, кольцо С3Н6 очень легко размыкается под действием галогенов и галогеноводоордов, а исходное соединение интенсивно каталитически гидрируется. Таким образом, прочность циклоалканов возрастает в ряду
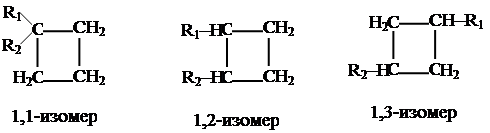
Более того, с n > 5 энергия всех циклоалканов примерно одинакова, что не соответствует указанному выше подходу. Дело в том, что циклоалканы могут иметь различную пространственную структуру. Примером служит циклогексан, для которого возможны структуры: кресло и ванна (рис. 5). Изомерия циклоалканов.Для подобных соединений возможна как структурная, так и пространственная изомерия: 1. Изомерия строения углеродного скелета может быть связана с различными причинами: 1а. С разной величиной цикла, например, для условной (эмпирической) молекулярной формулы С5Н10 имеем:
1б. Со строением боковых цепей.
1в. С различным относительным положением в цикле. Покажем это на примере дизамещенного циклобутана (3 изомера).
2. Стереоизомерия, возможная при наличии двух заместителей. Два заместителя, находящиеся в молекуле циклоалкана у различных атомов углерода, могут быть расположены: – по одну сторону от плоскости цикла; такой дизамещённый циклоалкан называют цис-изомером; – по разные стороны от плоскости цикла; такой дизамещённый циклоалкан называют транс-изомером. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 ; n(CH4) = 1 моль
; n(CH4) = 1 моль ; n(Cl2) = 1,5 моль
; n(Cl2) = 1,5 моль ; 12k – 9k = 9; k = 3.
; 12k – 9k = 9; k = 3.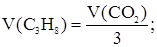
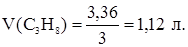
 С + 2Н2.
С + 2Н2. .
. Циклоалканы (нафтеновые углеводороды) различаются размерами цикла:
Циклоалканы (нафтеновые углеводороды) различаются размерами цикла: Циклоалканы различают по числу членов в цикле и числу циклических группировок в соединении. Соединение с одной такой группировкой называют в соответствии с общими правилами, при этом главной считается цепь, образующая цикл. Перед ее названием добавляется приставка «цикло». Нумерацию углеродных атомов проводят таким образом, чтобы сумма номеров заместителей была наименьшей. Номер одного заместителя не указывается.
Циклоалканы различают по числу членов в цикле и числу циклических группировок в соединении. Соединение с одной такой группировкой называют в соответствии с общими правилами, при этом главной считается цепь, образующая цикл. Перед ее названием добавляется приставка «цикло». Нумерацию углеродных атомов проводят таким образом, чтобы сумма номеров заместителей была наименьшей. Номер одного заместителя не указывается.