
|
|
Химические свойства алканов1. Алкановые углеводороды, как и все вообще органические соединения, способны сгорать при взаимодействии с кислородом с образованием оксида углерода (IV) и воды СН4 + 2О2 ® СО2 + 2Н2О – DН1 2С2Н6 + 7О2 ® 4СО2 + 6Н2О – DН2 Конечно, величина теплового эффекта определяется природой алкана, то есть в расчете на 1 моль сгорающего вещества DН1 ¹ DН2. 2. Эти вещества участвуют в каталитическом окислении, давая промежуточные продукты (неполное окисление). Таким образом, можно получать, например, жирные (карбоновые) кислоты R–H Символ t означает протекание процесса при повышенных температурах, 3. Алканы участвуют в процессе крекинга. Крекинг – деструкция молекул по С–С-связи при t ³ 1000 °С без доступа воздуха с образованием более легких алканов из подобных веществ с большей молярной массой. 3.1. СnH2n+2 при n > m и n > p. 3.2. Алканы подвергаются каталитическому пиролизу без доступа воздуха с доведением деструкции до элементарных продуктов СН4 2СН4 4. Дегидрирование (отщепление Н2) СnH2n+2
AlCl3 – кислота Льюиса, имеющая свободные орбитали для приема электронной пары. 6. Реакции радикального замещения 6а. Галогенирование С2Н6 + 6F2 ® C2F6 + 6HF 6б. Сульфирование R–H + H2SO4(дымящая) ® R–SO3H + H2O 6в. Нитрование R–H + HO-NO2 ® R–NO2 + H2O Механизм радикальных реакций рассмотрим на примере галогенирования алканов. Хлор реагирует с предельными углеводородами только под влиянием света, нагревания (300 °С) или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода: СН4 + С12 ® СН3С1 + НС1 СН3С1 + С12 ® СН2С12 + НС1 СН2С12 + С12 ® CHC13 + HC1 СНС13 + С12 ® СС14 + НС1 Реакция протекает по цепному радикальному механизму. С12 ® 2С1· зарождение цепи СН3–Н + C1·® CH3· + HC1 развитие цепи СН3· + С12 ® СН3С1 + C1· развитие цепи 2С1· ® С12 обрыв цепи СН3· + С1· ® СН3С1 обрыв цепи СН3· + СН3· ® СН3–СН3 обрыв цепи Любая радикальная реакция включает три этапа: зарождение, рост и обрыв радикальной цепи. Стадия, где образуются радикалы, даёт начало данному процессу. При этом возникает естественный вопрос: почему такому расщеплению подвергаются в первую очередь молекулы хлора, а не другого участника реакции – метана? Причина такой избирательности – в различной прочности связей С–Н и С1–С1, энергии разрыва которых равны 435 и На втором этапе обсуждаемой реакции – стадии развития цепи – возможно либо образование метильного радикала (схема 1), либо радикала водорода Н· (схема 2). Схема 1 СН3–Н + C1·® CH3· + HC1 DН = +2 кДж/моль СН3· + С1–С1 ® СН3С1 + C1· DН = –106 кДж/моль Схема 2 СН3–Н + C1·® CH3C1 + H· DН = +85 кДж/моль Н· + С1–С1 ® Н–С1 + C1· DН = –189 кДж/моль Как видно из величин и знака DН,схема 2 – энергетически неприемлема. Реакция, в которой образуется радикал Н·, высокоэндотермична и требует для своего осуществления большой энергии активации (если использовать принцип Бертло). Проведенные расчеты показали, что если бы этот процесс в самом деле имел место, то константа скорости образования метилхлорида была бы исчезающе малой и равной 10–12 моль/л×с. Время полупревращения такой реакции огромно – 3 000 лет, что не согласуется с экспериментом: смеси алканов с хлором на свету со взрывом (за миллисекунды). На стадии обрыва цепи наряду с рекомбинацией радикалов возможны и другие пути исчезновения радикальных частиц, например, реакция радикального диспропорционирования, которая имеет место, например, при высокотемпературном крекинге алканов: СН3СН2· + СН3СН2· ® СН3–СН3 + СН2=СН2 Введение ингибиторов (от латинского inhibere – сдерживать, останавливать) также тормозит радикальные процессы. В качестве таких радикальных «ловушек» могут выступать гидрохинон, йод, оксид азота, трифениламин ((С6Н5)3С–NH2) и др. Характер реакции галогенирования алканов в существенной степени определяется природой галогена. Реакция с йодом в целом эндотермична RI + HI ® RH + I2 Этот процесс используют для синтеза предельных углеводородов. Реакция прямого фторирования – неконтролируемый процесс Если в молекуле углеводорода имеются неравноценные атомы углерода (первичные, вторичные или третичные), то и замещение водородных атомов, связанных с ними, будет происходить с различной скоростью. Относительная реакционная способность связей С–Н не остается постоянной: при фторировании их химическое поведение почти ничем не отличается, а вот уже при бромировании различие в реакционной способности достигает нескольких порядков (по константам скоростей). Ниже представлены значения относительных скоростей галогенирования (С) предельных углеводородов, содержащих первичные, вторичные и третичные атомы углерода:
* Условно принят за 1 Высокая реакционная способность атома фтора обуславливает его низкую избирательность (селективность). Из приведенных значений относительных скоростей галогенирования видно, что бромирование наиболее избирательно. Это связано с низкой реакционной способностью атома брома. Активность радикала по отношению к данному конкретному соединению тем выше, чем больше выигрыш энергии при образовании новой связи галоген–Н, который определяется как разность энергии образования «новой» связи галоген–Н и «старой» С–Н – связи. Относительная реакционная способность ряда радикалов приведена ниже: F· > ОН· > Сl· > СН > Вr· > ROO· Преимущественная атака по третичному углеродному атому вызвана тем, что DНобр (R–Н – связи) в этом случае несколько ниже вследствие большей стабильности третичного радикала. Кроме того, прочность и энергия связи С–Н возрастает от третичного атома к первичному. 7. Частные реакции на примере метана. 7.1. Конверсия метана СН4 + Н2О 2СН4 + 2Н2О 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
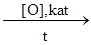 R1–COOH + R2–COOH + R3–COOH +…
R1–COOH + R2–COOH + R3–COOH +…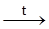 СmH2m+2 + СpH2p,
СmH2m+2 + СpH2p,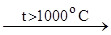 C + 2H2
C + 2H2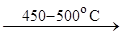 СnH2n + H2
СnH2n + H2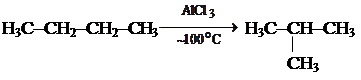 5. Изомеризация
5. Изомеризация CO + 3H2
CO + 3H2