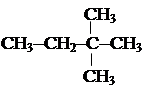|
|
Главный источник сравнительно тяжелых предельных углеводородов – нефть, легких – природный газ. Химические (синтетические) методы получения алканов преимущественно следующие.1. Гидрирование (взаимодействие с водородом) непредельных углеводородов, например, пропилена Н3С-СН=СН2 + Н2 Внимательный читатель, конечно, понял, что реакция гидрирования представляет собой присоединение водорода к субстрату. 2. Восстановление галогенпроизводных на примере 1-хлорпропана. Н3С-СН2-СН2Cl + H2 3. Гидролиз металлорганических соединений Н3С-СН2-СН2MgI + HOH ® Н3С-СН2-СН3 + MgOHI Zn(CH3)2 + 2HOH ® 2CH4 + Zn(OH)2 4. Взаимодействие щелочных металлов с галогенпроизводными 2H3C-CH2Cl + 2Na ® H3C-CH2-СН2-СН3 + 2NaCl 5. Сплавление солей карбоновых кислот со щелочами. В этом случае образуются алканы, содержащие в молекуле на один атом углерода меньше, чем в исходной соли. CH3COONa + NaOH ® CH4 + Na2CO3 CH3CH2COONa + NaOH ® C2H6 + Na2CO3 6. Электролиз солей карбоновых кислот. В частном процессе электролиза ацетата натрия суммарная реакция имеет вид 2CH3COONa + 2НOH Окисление ацетат-иона происходит на аноде, восстановление воды – на катоде. При этом реализуются частные электродные реакции. Приведем несколько частных реакций получения определенных алканов. 7. Реакция Фишера – Тропша СО + 3Н2 СО + 4Н2 8. Гидролиз карбида алюминия Al4C3 + 12HOH ® 4Al(OH)3 + 3CH4 Физические свойства алканов Исходя из самых общих закономерностей, можно отметить следующее. При нормальных условиях (н. у.) алканы с числом углеродных атомов в молекуле С1…С4 – газы, С5…С15 – жидкости, С16 и Сi с i > 16 при н. у. – твердые вещества. В таблице 1 приведены некоторые физические характеристики алканов. Таблица 1 Физические характеристики некоторых нормальных углеводородов
a* - поляризуемость молекул
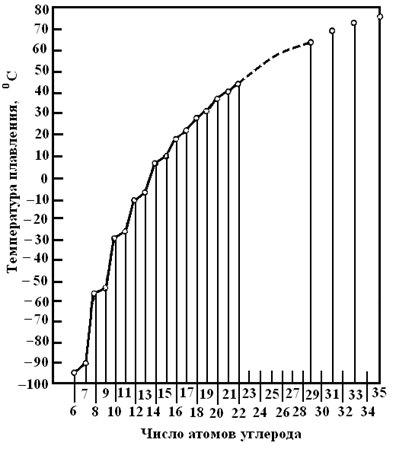
Легко видеть, что наблюдается тенденция возрастания Тпл и Ткип алканов с ростом их молекулярной массы или увеличение числа атомов углерода в молекуле. Это объясняется существенной зависимостью дисперсионного типа межмолекулярного взаимодействия (взаимодействия Ван-дер-Ваальса) от массы молекул. Ранее (Ч I настоящего пособия) приведена известная зависимость, характеризующая энергию дисперсионного взаимодействия, которая имеет вид (Ф. Лондон, 1930 г):
где h – постоянная М. Планка, n - частота колебаний, соответствующая энергии частиц (атомов) при абсолютном нуле (Т = 0 К), a - поляризуемость частиц, r – расстояние между молекулами. Ориентационным и индукционным взаимодействиями применительно к молекулам алканов можно пренебречь, так как их дипольный момент равен нулю. Таким образом, опосредованно молярная масса алканов учтена в величине их поляризуемости. Более подробно зависимость температуры плавления нормальных парафиновых углеводородов показана на рис. 10 (данные А.Н. Несмеянова и Н.А. Несмеянова).
Рис. 10. Зависимость температуры плавления нормальных парафиновых углеводородов от числа атомов углерода в молекуле.
Интересно было выяснить, как влияет разветвление алканов на физические характеристики соединений. Соответствующие данные представлены в таблице 2. Таким образом, разветвленные алканы кипят и плавятся при более низких температурах, чем вещества нормального строения. В ряде случаев это связывается с большим размером расстояний между отдельными взаимодействующими молекулами в конденсированном (твердом и жидком) состоянии, что выражается в снижении константы дисперсионного взаимодействия. На научном языке это связывается со стерическим (упаковочным) фактором. Чем меньше степень разветвления, тем плотнее упаковка молекул, например, в твёрдом состоянии, тем сильнее силы взаимного притяжения между ними и тем больше энергии (в том числе тепловой) требуется для перевода вещества в жидкое состояние. Таблица 2 Влияние разветвления молекул алканов на их физические характеристики

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
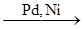 Н3С-СН2-СН3
Н3С-СН2-СН3 Н3С-СН2-СН3 + HCl
Н3С-СН2-СН3 + HCl C2H6 + 2CO2 + Н2 + 2NaOH
C2H6 + 2CO2 + Н2 + 2NaOH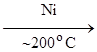 СН4 + Н2О(г)
СН4 + Н2О(г) СН4 + 2Н2О(г)
СН4 + 2Н2О(г)
 ,
,