
|
|
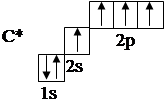
ПРЕДЕЛЬНЫЕ (НАСЫЩЕННЫЕ) УГЛЕВОДОРОДЫВ самой общей классификации, в которой за основу берется строение углеродного скелета, насыщенные углеводороды делят на две большие группы: 1. Алифатические, характеризующиеся открытой углеродной цепью. 2. Циклические, углеродная цепь которых замкнута. В свою очередь, те и другие в зависимости от характера связей между атомами углерода (С–С; С=С; СºС) делятся на насыщенные углеводороды, для которых характерна известная читателям из школьного курса химии Насыщенные углеводороды включают алканы и циклоалканы. Алканы Алканы представляют собой предельные углеводороды, так как в них валентности атомов углерода до предела насыщены атомами водорода. Как уже отмечалось выше, формула их гомологического ряда имеет вид СnH2n+2. При минимальной величине n = 1 имеем СН4, таким образом, метан является родоначальником гомологического ряда алканов. Углерод в органических соединениях проявляет валентность 4. Исходя из электронного строения его атома в нормальном (С – 1s22s22p2) и возбужденном (С* – 1s22s12p3) состоянии, в органических соединениях углерод всегда возбужден. Изобразим строение его атома в этом состоянии, исходя из распределения электронов по орбиталям.
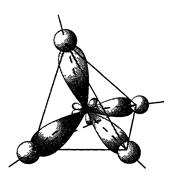
Таким образом, образующими связь являются 1 электрон 2s- и 3 электрона 2р-орбитали. Так как все связи, например, в метане равноценны, то можно принять, что все орбитали возбужденного атома углерода, занятые валентными электронами, гибридизованы. Имеет место sp3-гибридизация с образованием четырех гибридных орбиталей, образованных в результате гибридизации одной 2s- и трех 2р-исходных орбиталей. В случае sp3 -гибридизации гибридные орбитали направлены к вершине тетраэдра (рис. 8).
Рис. 8. Расположение sp3-гибридных электронных орбиталей в молекуле метана. Согласно представлениям, развитым Л. Полингом, ввиду близости энергии 2s- и 2р-орбиталей, они могут взаимодействовать между собой, давая четыре энергетически равноценных гибридных sp3-орбитали, располагающиеся друг относительно друга под углом 109°28¢. Гибридные орбитали вытянуты в сторону образования связи, например, между атомами углерода и водорода. Последние на рис. 1 показаны в виде сфер. Такие орбитали при образовании связей создают области повышенной вероятности нахождения электронов, образующих связь, симметричные относительно линий, соединяющих центры взаимодействующих атомов. Для этой связи характерны следующие свойства. 1. Относительная химическая инертность вследствие высокой прочности. 2. Максимум электронной плотности расположен симметрично относительно оси, соединяющей атомы, поэтому возможно свободное вращение вдоль этой оси без изменения перекрывания орбиталей (образование конформеров). 3. Длина связи 0,154 нм; угол между направлениями орбиталей 109,5°. 4. Электроотрицательность атома С в sр3-гибридном состоянии 2,51. Изомерия алканов. Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
Число изомеров быстро нарастает с увеличением числа атомов углерода в молекуле алкана. Обозначим нижним индексом число таких атомов. Тогда имеем: С6 – 5 изомеров; С7 – 9 изомеров; С8 – 18 изомеров; С20 – 366319 изомеров. В углеводородах вообще, а в алканах, в частности, различают атомы углерода 4-х типов: атом С, соединяющийся, в свою очередь, только с одним углеродным атомом – превичный (п); связанный с двумя – вторичный (в); с тремя – третичный (т) и с четырьмя – четвертичный (ч) (рис. 9).
Рис. 9. Типы атомов углерода в молекулах органических соединений.
Номенклатура алканов. Рассмотрим этот вопрос в более общем плане, так как он касается всех классов химических соединений. В органической химии для наименования соединений существует несколько номенклатур: историческая или тривиальная; рациональная; женевская; льежская; номенклатура ИЮПАК (международный союз по чистой и прикладной химии). Историческая номенклатура возникла в древние времена, когда органическим соединениям присваивали случайные названия. Большей частью эти названия указывают на происхождение веществ. Например, муравьиная, уксусная, щавелевая, янтарная, яблочная, винная кислоты, древесный спирт В основу рациональной номенклатуры положены названия простейших соединений (первых членов гомологического ряда). Другие соединения рассматриваются как производные простейших соединений, в которых атомы водорода замещены органическими остатками или радикалами. Так, все предельные углеводороды согласно рациональной номенклатуре рассматриваются как производные метана, насыщенные спирты – как производные простейшего метилового спирта, или карбинола, и т. д. Радикал ·СН3 называется метилом, простейший спирт – карбинол, или метиловый спирт, имеет структурную формулу СН3–ОН. Если в карбиноле заменить один водородный атом радикалом ·СН3, то получится метилкарбинол СН3–СН2ОН (этиловый, или винный, спирт). Диметилкарбинол получится, если два водородных атома в карбиноле заместить метильным радикалом:
Приставка ди- означает два. При замене всех атомов водорода метильными радикалами получится триметилкарбинол:
Атомы водорода в карбиноле могут быть замещены более сложными радикалами. Рациональная номенклатура позволяет называть сравнительно простые органические соединения. В случае более сложных соединений, например, начиная с углеводородов состава С8Н18, не все структурные изомеры могут быть названы с ее помощью. Поэтому, чтобы упорядочить номенклатуру органических соединений, на международном конгрессе химиков в 1889 г. в Париже была создана международная химическая комиссия, работа которой завершилась в 1892 г. Международным химическим конгрессом в Женеве, где была выработана номенклатура, получившая название женевской.
(пропанон); Названия изомерных соединений образуют следующим образом. 1. Выбирается главная цепь – самая длинная неразветвленная углеродная цепь, содержащая функциональную группу, характерную для данного гомологического ряда или кратную связь. 2. Углеводородные остатки, находящиеся в боковой цепи, рассматриваются как заместители водородных атомов в главной цепи. Заместителями могут считаться и функциональные группы, например, галогены, аминогруппа 3. Углеродные атомы цепи нумеруются, начиная с того конца, к которому ближе заместитель или функциональная группа. 4. Называется предельный углеводород, соответствующий главной цепи, и изменяется или прибавляется окончание, соответствующее данному гомологическому ряду.
Дальнейшее развитие органической химии показало, что женевская номенклатура нуждается в усовершенствовании. Например, многие циклические соединения и элементоорганические соединения нельзя было назвать по женевской номенклатуре. В 1930 г. на десятой конференции Международного союза чистой и прикладной химии (International Union of Pure and Applied Chemistry, сокращенно IUPAC, ИЮПАК) в Льеже была принята новая номенклатура органических соединений. В льежской номенклатуре использованы те же методы построения названий, что и в женевской. Различие заключается лишь в способе их применения. Например, льежская номенклатура допускает для каждого соединения не одно, а несколько названий, среди которых рекомендуется выбирать самое простое и удобное. За основу может быть принята не самая длинная углеродная цепь, а более короткая, но более разветвленная или содержащая функциональную группу. Льежская номенклатура привела к множественности названий. Кроме того, некоторые крупнейшие справочники и периодические издания не считались с ее правилами. Это вносило большую путаницу в названия органических соединений. Поэтому в 1957 г. на конференции в Париже была принята новая номенклатура углеводородов, всех видов циклических и элементоорганических соединений, известная под названием правил ИЮПАК 1957 г. Номенклатура ИЮПАК устранила множественность в названиях органических соединений. Однако и эта номенклатура окончательно еще не доработана. В настоящее время в органической химии применяют все указанные выше виды номенклатур. В нашей стране придерживаются преимущественно правил женевской номенклатуры и там, где это нужно, пользуются правилами ИЮПАК, в основе которых лежат правила женевской номенклатуры. Рассмотрим положения систематической (1957 г., ИЮПАК) номенклатуры применительно к алканам. В этом случае названия разветвленных алканов составляют по следующей схеме (алгоритму): 1. В графической (это точнее, чем понятие «структурная») формуле выбирают самую длинную цепь. 2. Цепь (точнее атомы углерода) нумеруют с конца, к которому ближе ответвление, которое принимают за радикал (заместитель). 3. Называют соединение в следующем порядке: 3.1. Перечисляют в цепи номера атомов углерода, при которых имеются ответвляющиеся радикалы. Если при одном и том же атоме имеется два радикала, то эту цифру называют дважды. 3.2. Называют радикалы в алфавитном порядке – метил, пропил, этил и т. д. Если одинаковых радикалов несколько, то добавляют умножающую приставку (ди-, три-, тетра-, пента- и т. д.)
Приведем несколько примеров.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

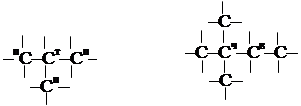
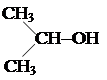
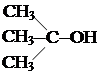
 В основу женевской номенклатуры положены названия предельные углеводородов. Гомологический ряд соединений, согласно этой номенклатуре обозначается функциональным окончанием. Предельные углеводороды получили окончание -ан (для них сохранены исторические названия), этиленовые углеводороды – окончание -ен, ацетиленовые – -ин , спирты – -ол, альдегиды – -аль, кетоны – -он, кислоты – -овая кислота. Например: СН3-СН2-СН3 (пропан); СН3-СН=СН2 (пропен); СН3-СºСН (пропин);
В основу женевской номенклатуры положены названия предельные углеводородов. Гомологический ряд соединений, согласно этой номенклатуре обозначается функциональным окончанием. Предельные углеводороды получили окончание -ан (для них сохранены исторические названия), этиленовые углеводороды – окончание -ен, ацетиленовые – -ин , спирты – -ол, альдегиды – -аль, кетоны – -он, кислоты – -овая кислота. Например: СН3-СН2-СН3 (пропан); СН3-СН=СН2 (пропен); СН3-СºСН (пропин);  СН3-СН2-СООН (пропановая кислота).
СН3-СН2-СООН (пропановая кислота). 5. Положение радикалов (начиная с простейшего) и функциональных групп определяется соответствующим атомом углерода главной цепи. Одинаковые радикалы суммируются. Например:
5. Положение радикалов (начиная с простейшего) и функциональных групп определяется соответствующим атомом углерода главной цепи. Одинаковые радикалы суммируются. Например:

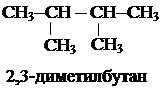

 3.3. Называют главную углеродную цепь.
3.3. Называют главную углеродную цепь.




