
|
|
Изомерия органических соединенийИзомераминазываются соединения, имеющие одинаковый качественный и количественный состав (молекулярную формулу), но отличаются друг от друга последовательностью связывания атомов или расположением их в пространстве.Поскольку строение этих соединений разное, то и химические или физические свойства изомеров отличаются. Типы изомерии: структурная (изомеры строения) и стереоизомерия (пространственная). Структурная изомерия может быть трёх видов: – изомерия углеродного скелета (изомеры по строению углеродной цепи), например бутан (соединение неразветвлённого или нормального строения) и 2-метилпропан (соединение разветвлённого строения); – изомеры положения функциональных групп (или кратных связей), например 1-бутанол (гидроксильная группа связана с 1-м атомом углерода в цепи) и 2-бутанол (гидроксильная группа связана с 2-м атомом углерода в цепи); – изомеры функциональной группы (или межклассовая изомерия), например, 1-бутанол (спирт) и диэтиловый эфир (простой эфир). Стереоизомерия подразделяется на конформационную и конфигурационную. Конформации молекулы представляют собой различные её геометрические формы, возникающие в результате вращения вокруг простых s-связей. Конфигурация – это порядок расположения атомов в пространстве без учёта различий, возникающих вследствие вращения вокруг простых Конформации органических молекул.Поворот вокруг s-связи С–С совершается сравнительно легко, углеводородная цепь может принимать разные формы. Конформационные формы легко переходят друг в друга и поэтому не являются различными соединениями – это разные неустойчивые динамические формы одной и той же молекулы. Разность энергий между конформерами имеет тот же порядок, что и энергия теплового движения (несколько кДж/моль). Поэтому при обычных температурах нельзя выделить отдельные конформеры.
Рис. 2. Конформации пентана: а – заслонённая; б – заторможенная
На рис. 2 представлены конформации пентана по связи между вторым и третьим атомами углерода цепи. Видно, что в заслонённой конформации атомы водорода или углерода как бы заслоняют друг друга. Заторможенная конформация возникает в результате поворота одного из атомов на 60° и расстояние между несвязанными атомами несколько увеличивается, уменьшаются силы отталкивания электронных орбиталей атомов и такая конфигурация является энергетически более выгодной. Молекулы многих органических соединений представляют собой смеси конформеров, в результате теплового движения молекулы испытывают непрерывные конформационные превращения. Проекционные формулы Ньюмена.Для изображения конформаций используют проекционные формулы Ньюмена, получающиеся при проецировании на плоскость молекулы С–С – связи. В качестве примера на рис. 3 показаны конформации пентана относительно связи С2–С3. Ближайший к наблюдателю атом углерода (С2) обозначают точкой в центре круга; круг при этом символизирует удаленный атом углерода (С3). Три связи от атома изображают в виде линий, расходящихся из центра кру-
Рис. 3. Проекционные формула Ньюмена для а: заслонённой конформации пентана и б: заторможенной конформации пентана.
Конформации циклических соединений.Циклические не ароматические соединения, как правило, не являются плоскими. Для уменьшения углового и торсионного напряжений, которые могут возникнуть из-за разницы величин валентных углов и углов многоугольника, один или несколько атомов цикла могут находится в другой плоскости по отношению к остальным атомам. Так, пятичленные циклы могут иметь в пространстве форму конверта (рис. 4), а шестичленные – форму ванны или кресла (рис. 5).
Рис. 4. Конформация циклопентана
В конформации конверта один из атомов углерода выходит из плоскости, в которой расположены остальные четыре атома. Выходящим из плоскости может оказаться любой из пяти атомов и цикл поэтому как бы находится в постоянном волнообразном движении.
Рис. 5. Конформации циклогексана: а – кресло и б – ванна.
В конформациях кресла и ванны по 2 атома углерода находятся вне плоскости, в которой расположены ещё 4 атома. В кресловидной конформации циклогексана отсутствуют заслоненные положения атомов водорода и углерода: расположение атомов водорода у всех атомов углерода такое же, как в заторможенной конформации этана. Шесть связей С–Н, параллельные оси симметрии кресловидной формы циклогексана, направленные попеременно вверх и вниз, называются аксиальными(символ а). Остальные шесть С–Н связей расположены под углом 109,5° к этой оси и также попеременно направлены вверх и вниз. Эти связи называются экваториальными (символ е). Таким образом, у каждого атома углерода одна связь с атомом водорода расположена аксиально и одна–экваториально. Конформация кресла энергетически более выгодна. Конфигурационные изомеры. Оптическая изомерия.Конфигурационными называют стереоизомеры с различным расположением вокруг определенных атомов других атомов, радикалов или функциональных групп в пространстве относительно друг друга. К ним, прежде всего, относят энантиомеры – оптически активные вещества, являющиеся зеркальными отражениями друг друга. Какие же вещества называют оптически активными? Это соединения, способные изменять угол наклона плоскости поляризации плоскополяризованного света. Напомним, что обычный свет (солнца или лампы) представляет собой электромагнитные волны, в которых частицы колеблются во всех направлениях во взаимноперпендикулярных плоскостях и перпендикулярно направлению распространения волны. В плоскополяризованном свете колебания частиц лежат в одной и той же плоскости. Если луч проходит через прозрачное вещество, которое способно повернуть плоскость колебаний электрического поля на некоторый угол и придать им новое направление, то о таком веществе говорят, что оно обладает оптической активностью. Можно сформулировать два признака оптической активности органических соединений: наличие асимметрического атома углерода и отсутствие в молекуле элементов симметрии. Асимметрический атом углерода – атом, связанный с четырьмя различными атомами или группами, обычно обозначают звёздочкой: *С. Рассмотрим молекулу аланина (2-аминопропановой кислоты), аминокислоты входящей в состав белка (рис. 6). В молекуле есть один асимметрический атом углерода (второй, связанный с четырьмя различными заместителями: аминогруппой, карбоксильной группой, атомом водорода и метильной группой –СН3). Атом углерода карбоксильной группы асимметрически не является, т.к. у него не 4, а только 3 заместителя. Третий атом углерода (углерод метильной группы) асимметрическим также не является. Заместителей у него 4, но 3 из них одинаковые (атомы водорода). Молекула этого соединения несимметрична, следовательно, аланин является оптически активным соединением и может существовать в виде двух энантиомеров. Называют энантиомеры по D,L-номенклатуре, которая описывает относительную конфигурацию изомеров (относительно конфигурации глицеринового альдегида). Для того, чтобы изобразить и назвать энантиомер, углеродную цепь молекулы удобно расположить вертикально, тогда заместители у асимметрического атома углерода оказываются справа и слева от него. Если старший заместитель (в нашем случае аминогруппа) располагается слева, это L-изомер, если справа – это D-изомер (рис. 6).
Рис. 6. Энантиомеры аланина.
Энантиомеры, в отличие от изомеров, имеют одинаковые физические и химические свойства, отличаются только тем, что поворачивают плоскость поляризации плоскополяризованного света на один и тот же угол, но в противоположные стороны (один влево, другой вправо). Смесь, состоящая из равных мольных количеств энаантиомеров, называется рацемической смесью или рацематом. Рацемат оптически не активен. Несмотря на, казалось бы, такое незначительное различие в свойствах, биологическая активность энантиомеров сильно отличается. Так, например, в состав белков входят только L-энантиомеры аминокислот, этим объясняются особенности пространственного строения белков и определяется избирательность каталитического действия ферментов. D-изомеры аминокислот при попадании в организм могут вызвать различные негативные процессы, поэтому пространственную конфигурацию аминокислот необходимо учитывать при производстве лекарств и различных пищевых добавок. В нашем организме присутствует и изомер этого соединения, b-аланин (3-аминопропановая кислота). Это соединение не входит в состав белков и не является оптически активным, т.к. асимметрические атомы в нём отсутствуют. Первый атом углерода карбоксильной группы имеет только 3 заместителя, второй и третий – по 2 одинаковых заместителя (атомы водорода). Продолжим рассмотрение явления оптической изомерии. Вещества, для которых характерно это явление, часто еще называют стереоизомерами. Стереоизомеры тождественны по физическим и физико-химическим свойствам, но различаются в двух отношениях: 1. Кристаллизуются в формах, не имеющих плоской (плоскости) симметрии, но относятся друг к другу как предмет к своему зеркальному изображению, например, два типа кристаллов винной кислоты, выделив стереоизомерные винные кислоты.
2. Стереоизомеры, как уже отмечалось выше, по разному поляризуют свет.
Например,
L-спирт, a = –5,9° Для указанных веществ возможна лево- и правовращающие конфигурации. Рацемат – смесь равных количеств L- и D-изомеров, оптически неактивна.
Какие же конфигурации вращают плоскость поляризации света вправо и влево – особый вопрос. Он здесь не рассматривается. Острие к углероду – связи, расположенные над плоскостью чертежа, острием к заместителю – под этой плоскостью. Классическим примером стереоизомера являются:
* – ассиметричный атом. Число стереоизомеров равно 2n, где, как уже понял внимательный читатель, n – число ассиметричных оптически активных атомов. Геометрические (цис- и транс-) изомеры.К ним относят конфигурационные изомеры, содержащие p-связь. Этот вид диастереомерии характерен, в частности, для алкенов. Относительно плоскости p-связи одинаковые заместители у двух атомов углерода могут располагаться по одну (цис-)или по разные (транс-)стороны (рис. 7). Основная причина существования цис-и транс-изомеров заключается в невозможности вращения вокруг p-связи без ее нарушения.
Рис. 7. Геометрические изомеры 2-бутана.
Цис-и транс-изомеры имеют одинаковую последовательность связывания атомов, но отличаются друг от друга пространственным расположением заместителей и потому являются стереоизомерами. С другой стороны, их молекулы не содержат асимметрических атомов углерода и не являются оптически активными. Цис-и транс-изомеры обладают различными физическими свойствами, могут вступать в реакции (например, присоединения, с разной скоростью). Геометрические изомеры часто встречаются среди природных соединений, в частности для обеспечения остроты зрения особенно важен изомер ретинола (витамин А), в котором все 4 двойные связи находятся в транс-конфигурации. Углеводородные радикалы непредельных кислот, входящих в состав жидких жиров, находятся в цис-конфигурации относительно двойных связей. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Различают заслоненную и заторможенную конформации (рис. 2).
Различают заслоненную и заторможенную конформации (рис. 2).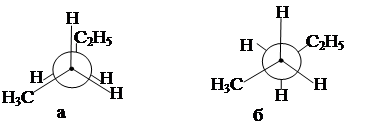





 Причина оптической стереизомерии обусловлена именно расположением замещающих групп у углеродного атома в состоянии sp3-гибридизации, то есть с предельным углеродом по вершинам тетраэдра (расположение атомов в пространствек, ведущее к наличию стереоизомерии, называется конфигурацией).
Причина оптической стереизомерии обусловлена именно расположением замещающих групп у углеродного атома в состоянии sp3-гибридизации, то есть с предельным углеродом по вершинам тетраэдра (расположение атомов в пространствек, ведущее к наличию стереоизомерии, называется конфигурацией). или обозначается в следующем виде:
или обозначается в следующем виде:



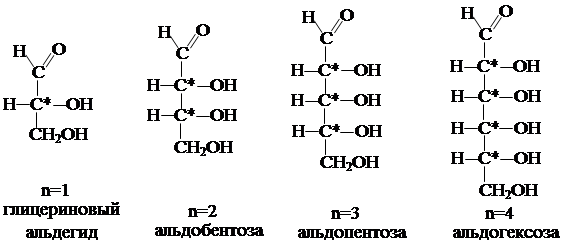 Число ассиметричных атомов может быть несколько, в общем случае n.
Число ассиметричных атомов может быть несколько, в общем случае n.