|
|
Теория строения органических соединений А.М. БутлероваСовременный подход к строению химических соединений вообще и органических, в частности, прошел длинный и сложный путь. Мы не будем рассматривать историю решения этого вопроса, проиллюстрируем лишь ниже, как изображали формулы химических соединений выдающиеся химики второй половины XIX века, показав одновременно, насколько упростилось современное изображение молекулярных формул тех же соединений.
Понимание структуры органических соединений удалось достичь с помощью теории строения химических соединений Александра Михайловича Бутлерова, сформулированной и впервые им представленной в докладе «О теории химического строения» на Международном съезде естествоиспытателей в 1861 г. Русский химик А.М. Бутлеров, с 1874 г академик Петербургской Академии Наук, родился 15 ноября 1828 г в городе Чистополе. В 1849 г окончил Казанский университет, где с 1857 г работал в должности профессора, а с 1863 г – его ректора. В 1868 г перешел на работу в Петербургский университет. А.М. Бутлеров – создатель теории химического строения органических соединений, лежащей в основе современной химии. Помимо этого он сделал в химии очень многое: 1. Открыл новый способ синтеза метиленйодида. 2. Синтезировал диацетат метилена и получил продукт его омыления – полимер формальдегида, а затем на основе его – гексаметилентетрамин (уротропин). 3. Предсказал и объяснил изомерию многих органических соединений, в частности, двух изомеров бутана, трех изомерных представителей пентана, различных спиртов и многое другое. Создал школу русских химиков (В.В. Марковников, А.М. Зайцев, Е.Е. Вагнер, А.Е. Фаворский и др.). Поборник высшего образования для женщин в России. Скончался ученый 17 августа 1886 г.
Основные положения теории химического строения А.М. Бутлерова следующие. 1. Атомы в молекулах соединены между собой в определенном порядке, согласно их валентности. Причем все валентности должны быть целиком затрачены на соединение атомов друг с другом.
Благодаря этому положению удается полностью избежать хаоса в представлении молекулярных формул органических соединений.
, для которого характерны все свойства одноатомных спир-
тов, не содержащих в молекулах ненасыщенных связей, Тпл = 114,15 °С,
, с Тпл = -138,5 °С, Ткип = -23,65 °С. Веществом химически
инертным, не реагирующим с металлическим натрием, с сильными кислотами и щелочами при умеренных температурах. 3. Имеет место взаимное влияние атомов и функциональных групп в молекулах химических соединений. Например, атомы водорода и кислорода в гидроксильной группе этанола соединяются очень прочно, в результате чего этиловый спирт практически не обладает кислотными свойствами в водных растворах. Замена этильного радикала –С2Н5 на фенильный –С6Н5 приводит к перераспределению электронной плотности в молекуле фенола С6Н5ОН, в результате чего на атоме водорода гидроксильной группы образуется больший частичный положительный заряд, чем в молекуле этанола, что увеличивает вероятность его отщепления в водном растворе. Фенол обладает хорошо выраженными в воде кислотными свойствами с константой диссоциации по уравнению С6Н5ОН ⇄ С6Н5О- + Н+, равной 10-10. Поэтому фенол по тривиальной номенклатуре называют карболовой кислотой. Можно привести и другой пример. Бензол С6Н6 с большим трудом вступает во взаимодействие по реакции замещения, лишь в жестких условиях (в присутствии катализаторов – безводных AlCl3 или FeCl3).
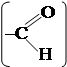
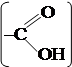
протекает очень легко с образованием 2,4,6-трибромфенола. В этом четко проявляется влияние ОН-группы на подвижность атомов водорода бензольного ядра. 4. Строение молекул может быть установлено посредством изучения химических свойств соединений. Например, их кислотные свойства целесообразно связать с наличием карбоксильной группы –СООН, способность к реакции серебряного зеркала – с присутствием в молекуле группы –СНО и т. д.,
структура которых имеет вид: и .

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|




 2. Свойства органических веществ зависят не только от их качественного (элементного) состава, но определяются и их строением. Например, соединение С2Н6О может быть этиловым спиртом
2. Свойства органических веществ зависят не только от их качественного (элементного) состава, но определяются и их строением. Например, соединение С2Н6О может быть этиловым спиртом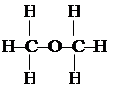 и диметиловым эфиром
и диметиловым эфиром
 В то же время взаимодействие фенола с молекулярным бромом (бромной водой) по реакции
В то же время взаимодействие фенола с молекулярным бромом (бромной водой) по реакции