
|
|
Структура органических соединенийКлассификация органических соединений основана на анализе двух аспектов строения молекул – строения углеродного скелета и наличия функциональных групп.
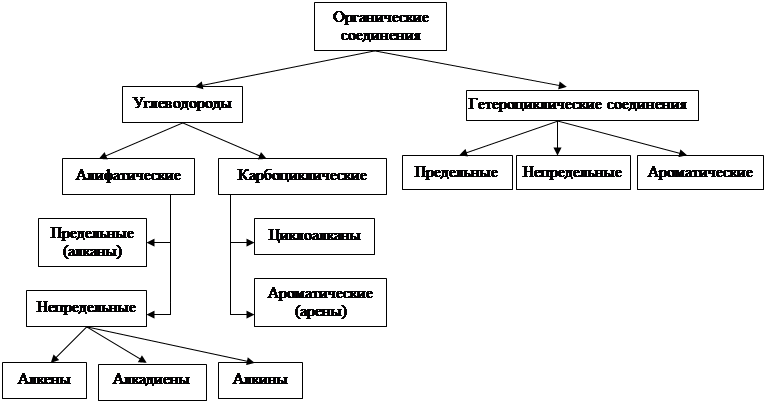
Рис. 1. Классификация органических соединений по строению углеродного скелета.
Основные классы производных углеводородов по наличию функциональных групп: – галогенопроизводные; – спирты и фенолы; – эфиры простые; – эфиры сложные; – карбонильные соединения: альдегиды и кетоны; – карбоновые кислоты; – сульфокислоты; – амины; – нитросоединения; – элементорганические (в том числе металлорганические) соединения. Конечно, представленная классификация далеко не полна. Более того, внутри каждого из указанных классов возможны и, конечно, существуют свои интересные и очень ценные классификации. Очень полезно рассматривать классы органических соединений как гомологические ряды – ряды сходных по строению соединений, обладающих близкими химическими свойствами, в котором отдельные члены ряда отличаются друг от друга лишь количеством групп –СН2–, эта группа называется гомологической разностью. Отметим, что М(СН2) равна 14 г/моль. Следовательно, молярные массы ближайших членов гомологического ряда отличаются на 14 г/моль.У членов гомологического ряда подавляющее большинство реакций протекает одинаково. Следовательно, зная химические реакции лишь одного члена ряда, можно с большой степенью вероятности утверждать, что такого же типа превращения протекают и с остальными членами гомологического ряда. Для любого гомологического ряда может быть выведена общая формула, отражающая соотношение между атомами углерода и водорода у членов этого ряда; такаяформула называется общей формулой гомологического ряда. Приведем примеры. Забегая несколько вперед и полагая, что читатели учебного пособия знакомы с курсом химии в программе средней школы, отметим следующие. Общая формула гомологического ряда алкановых углеводородов СnН2n+2, где n – число атомов углерода в молекуле химического соединения. Замена одного атома водорода в любом алкане на гидроксильную группу приводит к образованию предельных одноатомных спиртов на их основе с общей формулой гомологического ряда СnН2n+1ОН. Замена двух атомов водорода приводит к возникновению двухатомных спиртов. Общая формула таких гомологов СnН2n(ОН)2 и так далее. В общем случае имеем формулу гомологического ряда спиртов СnН2n+2-m(ОН)m, где m — число атомов водорода в молекуле алкана, замещённых на гидроксильную группу. Формула гомологического ряда алкеновых углеводородов (одна двойная связь в молекуле соединений) имеет соответственно вид СnН2n. Тогда замена одного атома водорода приводит к соответствующим одноатомным спиртам с формулой гомологического ряда СnН2n-1ОН. Далее – все как в предыдущем случае. Но заменять атом водорода в алкане можно не только на группу ОН. Замена его на атом галогена приводит к образованию галогенопроизводных с общей формулой гомологического ряда СnН2n+1Hal, где Hal – F, Cl, Br или I. Замена двух атомов водорода на галоген ведет к образованию дигалогенпроизводных и т. д. Точно таким же образом можно получить формулы гомологических рядов предельных СnН2n+2-m(СООН)m либо непредельных (одна двойная связь) –СnН2n-m(СООН)m карбоновых кислот.
или Сm+nH2(m+n)CO2.
Молекулярные формулы карбонильных соединений имеют вид: R–CHO – альдегиды или СnН2n+1СНО; R1–СO–R2 – кетоны или для R1 ¹ R2 СnН2n+1–СОСmH2m+1. Можно последнюю условную молекулярную формулу упростить Сm+nН2(m+n)+2СО. Приведем примеры условных молекулярных формул других классов: R–SO3H – сульфокислоты или СnН2n+1SO3H; R–NH2 – первичные амины или СnН2n+1NH2; R–(NH2)2 – вторичные амины или СnН2n(NH2)2. Подобные формулы соответствуют гомологическим рядам предельных аминов (не содержащих ненасыщенных связей в молекулах). R–NО2 – нитросоединения или общая формула предельных соединений СnН2n+1NО2. Знание формул гомологических рядов важно во многих случаях: 1) для установления конкретных молекулярных формул соединений различных химических классов. 2) для проведения самых различных количественных расчетов. Приведем некоторые примеры. Задача 1. Получить молекулярную формулу алкана, масса углерода в молекуле которого превышает массу водорода в 5 раз. Общая формула гомологического ряда алканов, указанная ранее, имеет вид СnН2n+2. Пусть имеется один моль алкана. Тогда масса углерода равна nM(C), или 12n, г; а масса водорода – (2n+2)M(H). Mi – молярная (так удобнее) масса химического элемента. Учитывая, что для атомарного водорода Исходя из условий задачи, можно записать 12n/(2n+2) = 5 n = 5 и молекулярная формула алкана имеет вид С5Н12. Задача 2. Усредненная массовая доля водорода в эквимолярной смеси (равное количество различных молекул) двух алканов равна 0,2. Определить молекулярные формулы входящих в смесь соединений. Пусть первое соединение имеет формулу СkН2k+2, второе – СpН2p+2. Примем, что в состав смеси входят по 1 моль первого и второго вещества. Если в состав смеси входят количества вещества в иных соотношениях, ничего не меняется помимо некоторого усложнения расчетов. Масса первого алкана равна М(СkН2k+2), г, второго М(СpН2p+2), г. Суммарная масса водорода в смеси (2k + 2p + 4), г, то есть 2(k + p + 2), г. Используя условие задачи, запишем
Из последнего уравнения легко получить зависимость 2(k + p) + 4 = 2,8(k + p) + 0,8; k + p = 4. Следовательно, k = 1 и p = 3 или наоборот. Отметим, что k = p = 2 невозможно, так как смесь не может быть представлена одним (индивидуальным) веществом. Молекулярные формулы алканов СН4 и С3Н8. Укажем на интересный факт. В этом случае вопреки математике можно оценить величины двух неизвестных, имея одно уравнение. Это становится возможным, так как вторую зависимость представляют закономерности органической химии. Однако, это наблюдается только в частных случаях. Например, в несколько более усложненном варианте подобной задачи необходимы дополнительные данные для составления двух уравнений. В качестве примера предлагаем читателям самостоятельно решить следующую задачу. Задача 3. Усредненная массовая доля водорода в эквимолярной смеси двух алканов равна 0,182, а отношение их молярных масс составляет 0,222. Определить молекулярные формулы входящих в смесь соединений. Ответ: СН4 и С5Н12. А мы рассмотрим решение следующей задачи. Задача 4. Оценить отношение масс углерода и водорода в молекулах этиленовых углеводородов. Можно ли в случае этих соединений определить молекулярную формулу вещества, зная подобные соотношения? Пусть имеется некоторый алкен с молекулярной формулой СnН2n. Тогда отношение масс углерода и водорода легко определить, если принять, что имеется 1 моль веществ. В этом случае масса углерода равна 12n, г, а водорода – 2n, г, что следует из равенства их молярных масс М(С) и М(Н) соответственно 12 г/моль и 1 г/моль. Отношение масс указанных химических элементов для соединений этого класса равно
Следовательно, оно постоянно для всех соединений гомологического ряда алкенов и определить строение конкретного вещества нельзя. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Приведем условные молекулярные формулы некоторых других классов органических соединений. R1–O–R2 – простые эфиры, продукты взаимодействия молекул спиртов одной (R1 º R2) или различной природы, Ri – углеводородные радикалы. Если они не имеют двойных либо иных ненасыщенных связей, то можно записать во втором случае СnН2n+1–О–СmH2m+1 или Сn+mН4n+2О. В более простом первом случае имеем (СnН2n+1)2О.
Приведем условные молекулярные формулы некоторых других классов органических соединений. R1–O–R2 – простые эфиры, продукты взаимодействия молекул спиртов одной (R1 º R2) или различной природы, Ri – углеводородные радикалы. Если они не имеют двойных либо иных ненасыщенных связей, то можно записать во втором случае СnН2n+1–О–СmH2m+1 или Сn+mН4n+2О. В более простом первом случае имеем (СnН2n+1)2О. – сложные эфиры (продукты взаимодействия одноатомных спиртов и одноосновных карбоновых кислот). Вновь, если в углеводородных радикалах отсутствуют ненасыщенные связи, можно записать для R1 ¹ R2
– сложные эфиры (продукты взаимодействия одноатомных спиртов и одноосновных карбоновых кислот). Вновь, если в углеводородных радикалах отсутствуют ненасыщенные связи, можно записать для R1 ¹ R2 .
. .
.