
|
|
Получение этиленоксида через этиленхлоргидринПроцесс получения этиленоксида из этилена через этиленхлоргидрин в течение длительного времени являлся основным промышленным способом по-лучения этиленоксида. По этой же технологии получают и пропиленоксид. В основе процесса лежит реакция гипохлоргидрирования олефиновых углеводо-родов с образованием a-хлоргидринов: RCH=CH2 + Сl2 + Н2O RCH(OH)CH2Cl + НСl. При хлоргидринировании аллилхлорида получают 1,3-хлоргидрин глице-рина, который используется для производства эпихлоргидрина, являющегося мономером для получения полиэпоксидов и промежуточным продуктом в син-тезе глицерина. Процесс осуществляют либо при совместном пропускании хлора и оле-фина через воду, либо при барботаже олефина через слабокислый раствор хлорноватистой кислоты. Механизм реакции может быть описан следующей схемой: Cl- RCH(Cl)CH2Cl Cl + RСH=CH2 RCH=CH2 [RCHCH2Cl] дихлоралкан Cl-Cl HO 2 RCH(Cl)CH2CI хлоргидрин
Дихлордиалкиловый эфир При гидролизе 1,2-хлоргидринов в основной среде образуются a-оксиды олефинов и гликоли-1,2:
Процесс получения этиленоксида через этиленхлоргидрин протекает в две стадии. На первой стадии из этилена и хлора в водной среде получают этилен-хлоргидрин (гипохлорирование):
CH2=CH2 + Cl2 + H2O ClCH2CH2OH + HCl .
На второй - взаимодействием этиленхлоргидрина с основанием, например c Са(ОН)2, получают этиленоксид:
2ClCH2CH2OH + Ca(OH)2 2H2C CH2 + CaCl2 + H2O O Этиленоксид
Гипохлорирование проводят при 318 К. Этилен подают с 10%-ным из-бытком по отношению хлору. Концентрацию этиленхлоргидрина в реакцион-ной смеси поддерживают на уровне 5%, чтобы свести к минимуму образование побочных продуктов. Выходящие из реактора газы, содержащие 10-20% этиле-на, охлаждают водой и нейтрализуют щелочью. Часть этих газов возвращают в реактор, а остальное, во избежание накопления в системе инертных примесей, сбрасывают в атмосферу. Раствор этиленхлоргидрина, выходящий из реактора, смешивают с 10-12%-ным раствором известкового молока и подают в омылитель, в котором его подогревают острым паром до 369-375 К. Пары этиленоксида, воды, дихлорэ-тана и других хлорорганических продуктов из омылителя охлаждают до 313-323 К и направляют в ректификационную колонну для отделения этиленоксида. Способ получения этиленоксида через этиленхлоргидрин отличается про-стотой оформления, низкими капиталовложениями и невысоким расходом электроэнергии. К недостаткам процесса можно отнести большой расход хлора и Са(ОН)2, а также то обстоятельство, что получаемый в процессе разбавленный водный раствор хлорида кальция загрязнен различными примесями и не может быть использован в промышленности. Поэтому производство этиленоксида через этиленхлоргидрин сопряжено с образованием большого количества сточных вод. Этот способ получения этиленоксида устарел и в настоящее время теряет свое промышленное значение.
Прямое окисление этилена
Впервые этиленоксид был получен прямым окислением этилена в 1931 г. одновременно Ленером в США и Лефортом во Франции. Все промышленные процессы прямого окисления этилена до этиленокси-да можно разделить на две группы: процессы, в которых используют воздух или обогащенный кислородом воздух, и процессы, в которых для применяюто-кисления 99,5%-й кислород. Первая установка по производству этиленоксида с использованием воз-духа в качестве окислителя была введена в действие в 1937 г. фирмой "Юнион Карбайд". Прямое окисление этилена протекает в соответствии со схемой
CH2=CH2 + 0,5O2 H2C CH2 O Одновременно происходят реакции:
H2C CH2 CH3CHO, O
CH2=CH2 + 0,5O2 CH3CHO,
CH2=CH2 + O2 2CH2O.
Процесс окисления проводят при 473-573 К. Реакция окисления этилена до этиленоксида экзотермична, выделяющееся тепло может значительно повы-сить температуру реакционной среды, вызвать образование точек перегрева в катализаторе и привести к снижению его производительности. Образование то-чек перегрева можно уменьшить путем осуществления процесса в двух реакци-онных зонах, расположенных последовательно. Давление не оказывает прямого воздействия на выход целевого продукта. В промышленности процесс обычно проводят под давлением 1,0-2,3 МПа. Обычно в промышленности применяют нанесенные серебряные катали-заторы. В качестве носителей используют g-А12О3 размером 3-8 мм. Катализа-торы готовят, пропитывая измельченный гранулированный носитель солями серебра, как правило, карбонатами, нитратами, лактатами или оксалатами. Про- питанный носитель сушат, подвергают тепловой обработке при 523-673 К, в процессе которой соль серебра разлагается, и образуется металлическое сереб-ро. В качестве промоторов используют соединения щелочных металлов: К, Сs, Rb. Увеличение времени контакта приводит к возрастанию конверсии этилена, однако селективность при этом уменьшается. Оптимальный состав газовой смеси, обедненной этиленом, содержит 4% этилена и 7% кислорода. При использовании газовых смесей с большим содер-жанием этилена [10-20 об.(%)] в них должно быть такое количество кислорода, чтобы мольное отношение этилена к кислороду составляло 7:1. Количество ацетилена, сернистых соединений и диолефинов не должно превышать 0,001% каждого, так как они отравляют катализатор и образуют взрывоопасные смеси с кислородом. Для исключения опасности взрыва в реакционную смесь вводят инертные газы – чаще всего азот, а также метан, этан. Состав безопасных газовых смесей приведен ниже. Предельная концентра-Предпочтительная кон- Компоненты ция, % (мол.) центрация, % (мол.)
СО2 3-15 5-10 Принципиальная технологическая схема получения этиленоксида приведена на рис. 9.5.
способу фирмы "Шелл" 1 - генератор пара; 2 - реактор; 3 - колонна отдувки СО2; 4 - абсорбер СО2; 5 - абсорбер оксида этилена; 6 - колонна для отпарки оксида этилена; 7 - фракционная колонна; 8 - колонна для дегидратации. Потоки: I- водяной пар; II – О2; III – этилен; IV– СО2; V- отходящие газы; VI- этиленоксид
Прямое окисление этилена является наиболее эффективным способом получения этиленоксида.
ПРОПИЛЕНОКСИД
Пропиленоксид (метилоксиран; 1,2-пропиленоксид) H2C—CH-CH3 O - бесцветная прозрачная жидкость с т. пл. 161 К, т. кип. 307,3 К, раство-ряется в большинстве органических растворителей и в воде: при 283 К раство-ряется 40,8% (мас.) пропиленоксида. Пропиленоксид был получен Озером по реакции 1-хлорпропанола-2 с ок-сидом свинца и водой:
O Сополимеры полипропиленоксида получают полиприсоединением про-пиленоксида к гликолям – моно- и дипропиленгликолям, бутандиолам, триолам – глицерину, триметилолпропану, пентаэритриту, сорбиту, глюкозе - и другим полифункциональным спиртам. Низкомолекулярный полипропиленокcид и его сополимеры с этиленокси-дом, тетрагидрофураном используют для производства полиуретанов, а сопо-лимеры пропиленоксида с аллилглицидиловым эфиром - в качестве эпоксидных каучуков (дайнаджен, парел): [—OCH2CH—]n—[—OCH2CH—]n CH3 CH2OCH2CH=CH2 Эти каучуки применяют главным образом в производстве деталей для ав-томобилей (шланги, прокладки и др.), в перспективе их можно будет использо-вать для изготовления озоностойких покрытий, антивибраторов, амортизато-ров. Пропиленоксид находит также применение во многих областях народно-го хозяйства: для получения полипропиленгликолей, пропиленгликоля-1,2 и его производных, используемых в производстве ненасыщенных полиэфиров, изо-пропаноламинов, исходных продуктов для получения ПАВ и главным образом гибких пенополиуретанов. В некоторых случаях пропиленоксид вытеснил эти-леноксид, так как его применение в качестве сырья оказалось намного эффек-тивнее с точки зрения охраны окружающей среды (например, в производстве эфиргликолей). Основные способы получения пропиленоксида представлены на схеме 9.1. В отличие от способа получения этиленоксида окислением этилена, ха-рактеризующегося высоким выходом основного продукта и низким образова-нием СО2 и различных примесей, для большинства способов получения пропи-леноксида характерно образование значительных количеств побочных продук-тов, которые в мольном соотношении превосходят выход основного продукта.
Схема 9.1
Прямое окисление пропана Окисление пропилена пероксидами Окисление пропилена через га-
и пропилена кислородом логенгидрин
Гидроперок-Органиче-Органиче-ПодгидИнтегриро-Хлор- Анодное электрохимическое окисление сидами скими пе-скими над-ринный ванный элек-гид- Окисление пропана в газовой фазе роксидами кислотами способ трохимиче-ринный В отсутствие катализатора В присутствии катализатора ский с бром-способ
Методы соокисления гидрином
В присут-Изо- - й АцетальдеКонвенциональны ствии ката-бутан, гид, на- способ лизаторов третИнтегри- дуксусная
(Со, Мn, - бу-рованный кислота арсенит, танол Комбинированные электро- борная ки-способы химиче- слота) ский спо- соб
Ячейка с диафрагмой В присутствии Этилбензол, стирол органических Ячейка с мембраной
кислот (му-
равьиная, ук- сусная) Получение пропиленоксида 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

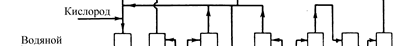
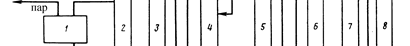
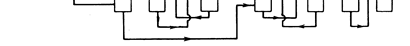 Рис. 9.5. Принципиальная технологическая схема получения этиленоксида по
Рис. 9.5. Принципиальная технологическая схема получения этиленоксида по