
|
|
Жидкофазное окисление пропилена пероксисоединениямиБолее перспективными являются процессы, в которых окисляющий агент (пероксид, надкислоты, гидропероксиды) образуется не in situ из кислорода и пропилена, а вводится в реактор. Окисление пропилена пероксидом водорода. Реакция окисления про-пилена пероксидом водорода осуществляется только в присутствии органиче-ских кислот (уксусной или муравьиной), катализаторов (осмия, рения, молиб-дена) или специальных органических растворителей при 288-353 К. Теоретически при взаимодействии пропилена с Н2О2 в присутствии кар-боновых кислот должны образовываться пропиленоксид и вода. На практике в результате протекания побочных реакций выход гликолей и их эфиров превы-шает выход пропиленоксида. Промышленное применение данного способа оп-ределяется стоимостью Н2О2. Полузаводская установка по производству про-пиленоксида с применением пероксида водорода создана в Бельгии фирмой "Пропилокс СА". Фирмы "Байер" и "" (ФРГ) разработали непрерывный метод по- Дегусса лучения пропиленоксида с применением в качестве окислителя надропионовой кислоты, образующейся при рециркуляции пропионовой кислоты и Н2О2 в при-сутствии серной кислоты. Окисление пропилена пероксидами.Различные пути прямого окисле-ния пропилена до пропиленоксида в промышленном плане потерпели неудачу. Это связано с тем, что при прямом окислении пропилена именно метильная группа окисляется легче всего, что приводит к существенному снижению се-лективности и образованию большого количества трудно разделяемых кисло-родсодержащих продуктов. Проблема была решена при использовании вместо кислорода в качестве окислителя гидропероксидов (ROOH) или надкислот (RCOOOH). Основная трудность в случае применения гидропероксидов или надки-слот для фиксации кислорода заключается в том, что использование этих со- единений в количествах, близких к стехиометрии, приводит к одновременному получению спирта или кислоты: СН3—СН=СН2 + ROOH СН3-СН—СН2 + ROH,
О Существует много пероксидных соединений, которые могут выполнять функцию окислителя в процессах получения пропиленоксида, однако, из-за экономических соображений используют гидропероксиды трет-бутила и этил-бензола, а также надуксусную и надпропионовую кислоты в качестве перкис-лот. Окисление органическими надкислотами. Органические надкислоты - надмуравьиная, надуксусная, надмалеиновая, надфталевая и другие реагируют с пропиленом с образованием пропиленоксида и соответствующих карбоновых кислот. Скорость эпоксидирования во многом зависит от природы растворителя и снижается в ряду: уксусная кислота, тетрахлорид углерода, бензол, метилэ-тилкетон, метанол, ацетон, этилацетат. Предпочтительной является надуксус-ная кислота, которая получается в процессе окисления пропилена в этилацетате или уксусной кислоте. Фирма "Дайсел" (Япония) реализовала этот метод на ус-тановке мощностью ~ 120000 т/год. На рис. 9.6 приведена схема установки синтеза пропиленоксида с исполь-зованием надуксусной кислоты.
кислоты (по данным компании "Дайсел") 1 - абсорбер; 2 - концентратор; 3 - реакция; 4 – блок отделения пропи- леноксида; 5 – блок перегонки под давлением; 6 – блок отделения приме- сей из этилацетата; 7 – блок разложения надкислоты; 8 – блок отделения уксусной кислоты; 9 – блок очистки оксида пропилена; 10 – блок отгонки легких фракций. Потоки: I – уксусная кислота; II – этилацетат; III - надуксусная кислота; IV – газообразные продукты (СО2, СН4, С2Н4, О2, С3Н6); V - смесь продук- тов; VI – пропилен+пропан; VII – пропилен; VIII – пропан; IX – уксусная кислота+надуксусная кислота; X – этилацетат; XI – азот; XII – эфиры гли- коля; XIII –этилацетат и другие продукты; XIV – легкие фракции; XV – ок- сид пропилена
Окисление органическими гидропероксидами. Окисление пропилена органическими гидропероксидами нашло уже применение в промышленности и рассматривается как весьма перспективное. Для получения органических гидропероксидов можно использовать изобу-тан, при окислении которого образуется трет-бутилгидропероксид: CH3 CH3 CH3
Окисление кислородом протекает в жидкой фазе в отсутствие катализатора при 383-403 К, давлении 3-3,5 МПа, продолжительности процесса ~ 7 ч при конверсии изобутана ~ 35%. Общий выход гидропероксида и спирта на прореа-гировавший изобутан равен ~ 95%.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
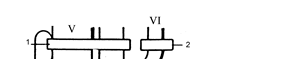


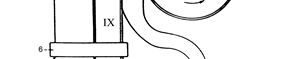

 Рис. 9.6. Схема установки синтеза пропиленоксида с применением надуксусной
Рис. 9.6. Схема установки синтеза пропиленоксида с применением надуксусной