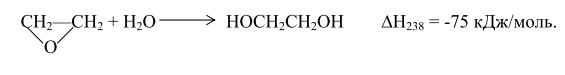|
|
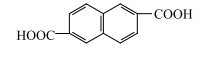
НАФТАЛИН-2,6-ДИКАРБОНОВАЯ КИСЛОТА
Нафталин-2,6-дикарбоновая кислота
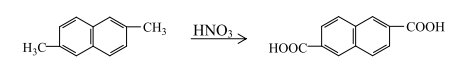
может быть использована самостоятельно или в смеси с метилнафтойными кислотами для получения полиэфиров, отличающихся большой твердостью и хорошей адгезией. В качестве спиртовых компонентов при получении полиэфиров используют бутиленгликоль-1,4 и глицерин. К числу перспективных для промышленного использования методов получения нафталин-2,6-дикарбоновой кислоты можно отнести окисление диалкил- или других 2,6-производных нафталина и термокаталитическое превращение щелочных солей более доступных нафталинкарбоновых кислот. Одним из путей получения нафталин-2,6-дикарбоновой кислоты является окисление 2,6-диметилнафталина:
Сырьем для получения 2,6-диметилнафталина могут служить соответствующие фракции коксохимических смол и продуктов переработки нефти. Для выделения 2,6-диметилнафталина из коксохимической смолы сначала извлекают широкую фракцию, выкипающую в пределах 523-553 К, из которой удаляют индол и дифенил, после чего ее подвергают дистилляции с выделением более узкой фракции – 531-541 К. Эту фракцию направляют на повторную дистилля-цию с выделением фракции 533-536 К, из которой после перекристаллизации и центрифугирования извлекают технический 2,6-диметилнафталин с температурой кристаллизации 363-368 К. По другому способу для синтеза нафталин-2,6-дикарбоновой кислоты используются более разнообразные и доступные источники сырья. В качестве исходных соединений в процессе термокаталитического превращения могут применяться соли 1-, 2-нафтойных кислот, смесь нафталинмоно- и нафталиндикарбоновых кислот, нафталевый ангидрид и т.д. В свою очередь, продукты, необходимые для синтеза нафталин-2,6-дикарбоновой кислоты, могут быть получены на основе монометилнафталинов и аценафтена, содержащихся в смолах коксования углей или газойлях каталитического крекинга. Поскольку условия изомеризации и диспропорционирования щелочных солей нафталинкарбоновых кислот незначительно отличаются от условия превращения солей бензолкарбоновых кислот, то для осуществления этих реакций могут быть использованы те же самые реакционные аппараты и технологические приемы. Например, смесь нафталевого ангидрида, карбоната калия, иоди-да кадмия и нафталина в соотношении 1:1:0,1:2 нагревают до 723-733 К во вращающейся шаровой мельнице под давлением СО2 1,0 МПа. Охлажденный продукт реакции в виде порошка для растворения в воде подают элеватором в экстрактор с мешалкой. Нерастворимые примеси отделяют на фильтре, а фильтрат обрабатывают серной кислотой при 353-363 К. Осадок трудно растворимой нафталин-2,6-дикарбоновой кислоты отфильтровывают и промывают водой.
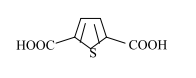
ТИОФЕН-2,5-ДИКАРБОНОВАЯ КИСЛОТА Тиофен-2,5-дикарбоновая кислота
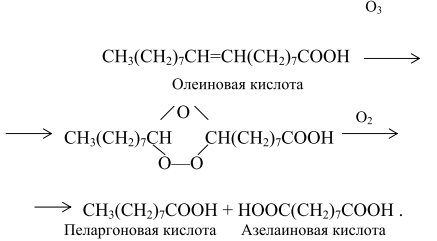
является мономером для получения электропроводящих полимеров. Тиофен-2,5-дикарбоновая кислота может быть получена из тиофена через его металлорганическое производное, окислением природного антибиотика "юнипаль", на основе адипиновой кислоты или 2-метилтиофен-5-монокарбоновой кислоты. Все эти методы многостадийны и трудоемки. Одним из путей промышленного производства этой кислоты является каталитическое диспропорционирование калиевой соли тиофен-2-карбоновой кислоты, которая получается нейтрализацией продукта окисления 2-метилтиофена, получаемого, в свою очередь, из пиперилена и сероводорода. АЗЕЛАИНОВАЯ КИСЛОТА Полиэфиры на основе азелаиновой кислоты HOOC(CH2)7COOH и этиленгликоля применяют при изготовлении бензо- и маслостойких трубопроводов, шлангов, электрошнуров. Дибутил-, диизобутил-, ди(2-этилбутил)-, диизооктил- и ди-(2-этилгексил)азелаинаты используют в качестве морозостойких пластификаторов поливинилхлорида, эфиров целлюлозы, каучуков. В промышленности азелаиновую кислоту получают из олеиновой или линолевой кислоты озонолизом, а также окислением азотной кислотой или другими окислителями. В процессе озонолиза при комнатной температуре и атмосферном давлении образуется озонид, подвергающийся при 348-393 К термоокислительному разложению в среде монокарбоновой кислоты с образованием азелаиновой кислоты и пеларгоновой кислот:
При окислении кислородом продуктов озонолиза олеиновой кислоты в уксусной кислоте при 330-370 К в качестве катализатора применяют ацетат марганца. Азелаиновую кислоту впервые выделил Лорен в 1837 г. из продуктов окисления олеиновой кислоты азотной кислотой. На этой реакции и был основан один из первых способов получения азелаиновой кислоты. К сожалению, наряду с основным продуктом при этом образуется большое число короткоцепных фрагментов, поэтому выделение азелаиновой кислоты в таком процессе сопряжено со значительными трудностями. ДИОЛЫ Получение этиленгликоля Этиленгликоль НОСН2СН2ОН – бесцветная вязкая гигроскопическая жидкость с т. кип. 470,6 К. Смешивается во всех отношениях с водой, различными спиртами, ацетоном, глицерином, не растворяется в ароматических углеводородах, хлороформе, сероуглероде и др. Этиленгликоль (около половины его мирового производства) используют для получения синтетических полиэфирных волокон и пленок. Его применяют также в производстве полиуретанов, алкидных смол, в текстильной промышленности и др. Около 40% производимого этиленгликоля применяют в произ-водстве антифризов. Основным промышленным способом получения этиленгликоля является гидратация этиленоксида. Гидратация этиленоксида Гидратация этиленоксида является экзотермической реакцией:
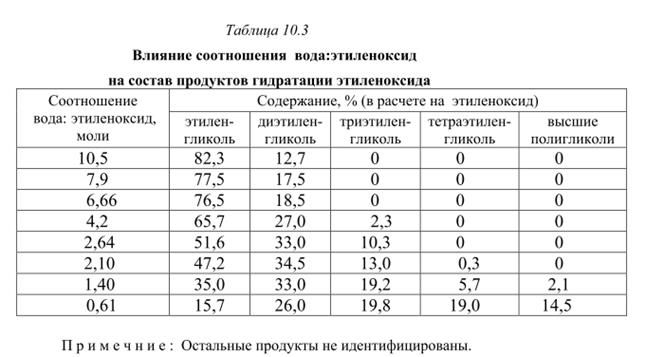
Процесс получения этиленоксида включает следующие стадии: - гидратация этиленоксида; - нейтрализация кислого катализатора; - перегонка и ректификация гликоля. Гидратацию этиленгликоля водой проводят при 423-473 К, 1,5-2,0 МПа и соотношении вода:этиленоксид, равном 20:1. Большой ибыток воды необходим для того, чтобы минимизировать образование при гидратации нежелательных полигликолей. В табл. 10.3 приведен состав продуктов гидратации этиленоксида в зависимости от соотношения этиленоксида и воды. Для ускорения процесса гидратации можно использовать кислый каталиатор, например серную кислоту. В этом случае после реакции ее нейтрализуют содой или щелочью. При времени пребывания реакционной смеси в усло-виях реакции в течении 1 ч достигается селективность по этиленгликолю ~90%, выход диэтиленгликоля составляет ~ 10% и триэтиленгликоля – 0,5%. Водный раствор гликолей концентрируется в каскаде выпарных аппаратов, работающих при уменьшающемся давлении от первого к последнему ап
парату от (0,6 МПа до 0,01 МПа). Гликоли получают удалением воды в колонне, работающей под вакуумом. Далее гликоли разделяют в нескольких колоннах. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|