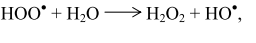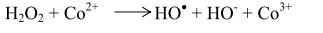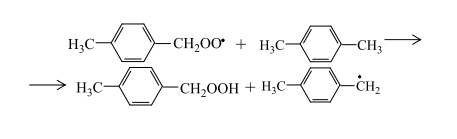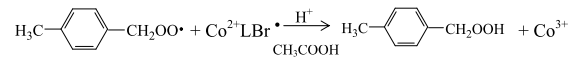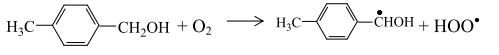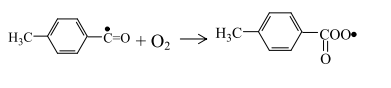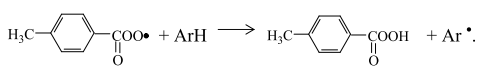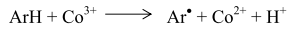|
|
ТЕРЕФТАЛЕВАЯ КИСЛОТА И ДИМЕТИЛТЕРЕФТАЛАТ
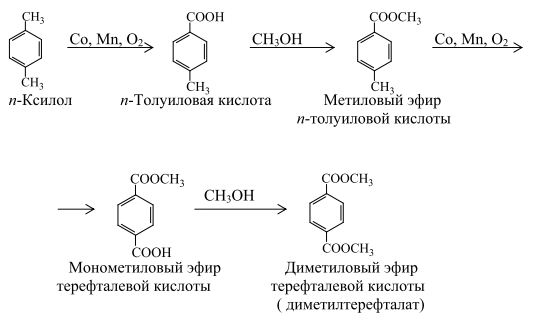
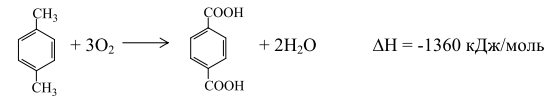
В настоящее время терефталевую кислоту (ТФК) или ее диметиловый эфир получают окислением п-ксилола:
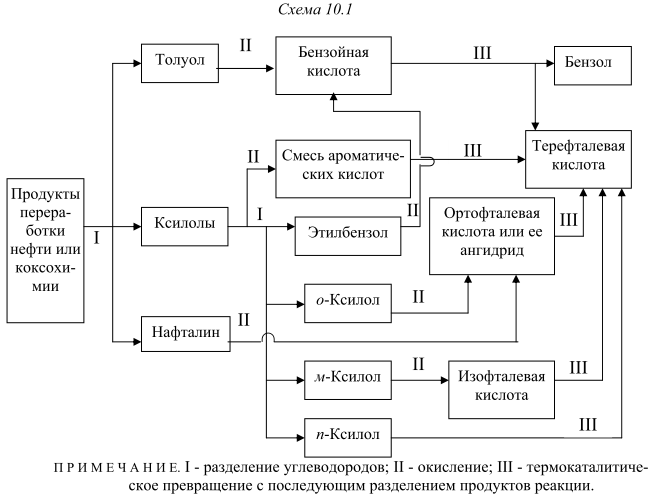
Количество получаемой кислоты можно увеличить, если включить в технологическую схему стадию термического превращения щелочных солей бензолкарбоновых кислот. В этом случае в качестве сырья можно использовать толуол, индивидуальные о- и м-ксилолы или смесь ксилолов без их предварительного разделения (рис. 10.1). Получение терефталевой кислоты со степенью чистоты, необходимой для поликонденсации, представляет собой трудную задачу. Вот почему обычно для этой цели используют диметилтерефталат (ДМТ) требуемой чистоты, который получается значительно легче, хотя при его использовании приходится в процессе поликонденсации удалять метанол. Поэтому в последнее время предложены другие варианты очистки ТФК. Одним из таких вариантов является получение "преполимера" - бис-гидроксиэтилтерефталата - взаимодействием двух молекул гликоля и одной молекулы терефталевой кислоты:
Благодаря хорошей растворимости преполимера в воде и органических растворителях очистка его не представляет большой сложности.
До 1963 г. всю получаемую окислением ТФК путем этерификации в ДМТ, который затем очищали обычными методами – кристаллизацией и перегонкой. По другому методу получения ДМТ (фирма "Виттен") процесс проводили последовательно в две стадии: - окисление смеси п-ксилола и метилового эфира п-толуиловой кислоты до п-толуиловой кислоты и монометилтерефталата; -этерификация этой смеси с получением метилового эфира п-толуиловой кислоты и ДМТ (после выделения ДМТ метиловый эфир п-толуиловой кислоты возвращают на стадию окисления). В Японии фирма "Тейчжин"освоила в промышленном масштабе процесс, основанной на изомеризации дикалийтерефталата (метод "Хенкель-I"). Позднее фирма "Мицубиси Кемикал" разработала собственный процесс, основанный на диспропорционировании бензоата калия (метод "Хенкель - II"). Образующийся в обоих процессах дикалийтерефталат подвергался очистке значительно легче, чем ТФК. ТФК выделяли, нейтрализуя дикалиевую соль ТФК серной кислотой. В последнее время в качестве мономера применяют бис-β-гидроксиэтилтерефталат (БГЭТ), получаемый взаимодействием этиленоксида с сырой ТФК. БГЭТ легко очищается и полимеризуется. Недостатками этого способа являются взрывоопасность этиленоксида и образование в качестве побочного продукта этиленгликоля. Впервые промышленное производство полиэфиров на основе БГЭТ осуществила фирма "Тойобо" (Япония), используя в качестве исходного сырья не сырую, а чистую ТФК. Однако небольшая стабильность и высокая гигроскопичность БГЭТ вызывали затруднения при транспортировке его на большие расстояния, что помешало широкому распространению этого способа. В 70-х годах японские фирмы "Марузен", "Торэй Лтд" и "Мицубиси" разработали и внедрили в промышленность одностадийные методы получения волокнообразующей ТФК. Такую кислоту без дополнительной очистки используют в производстве полиэфирных волокон, которые по качеству не уступают волокнам на основе очищенной ТФК и ДМТ. Доля ТФК, получаемая с применением методов очистки одностадийным способом, в суммарном объеме производства ТФК и ДМТ составляет более половины. 10.1.1. Процесс фирмы "Дюпон" Впервые ТФК в промышленности получили по этому методу. Окисление п-ксилола проводили в жидкой фазе при 438 К и давлении 1,0 МПа:
Полученная кислота не растворялась в реакционной смеси и ее отделяли осаждением. После сушки ТФК этерифицировали метанолом в присутствии в качестве катализатора серной кислоты при 423 К. Выход целевого продукта составлял 90%. Основным недостатком процесса являлось образование нитросоединений, что затрудняло очистку продукта и значительно ухудшало экономику процесса. В настоящее время метод окисления п-ксилола азотной кислотой потерял свое значение. 10.1.2. Процесс фирмы "Виттен" Процесс включает несколько стадий. Сначала окисляют п-ксилол кислородом воздуха до п-толуиловой кислоты:
Окисление проводят в каскаде реакторов в присутствии в качестве катализатора нафтената кобальта при 413-443 К и 0,4-0,7 МПа. Полученную п-толуиловую кислоту этерифицируют метанолом до п-метилтолуилата:
Этерификацию проводят при 473-523 К в присутствии в качестве катализатора толуолсульфокислоты. Далее n-метилтолуилат окисляют до метилтерефталата:
и этерифицируют до диметилтерефталата:
Одна метильная группа п-ксилола окисляется с высокой скоростью, образуя п-толуиловую кислоту, другая группа окисляется значительно медленнее.Фактически процесс осуществляют в две стадии: окисление и этерификация. Реакторы окисления расположены каскадом. В них подают катализатор – нафтенат кобальта, свежий и рециркулирующий п-ксилол и метил-п-толуилат. Воздух вводится в нижнюю часть реакторов. Реакцию проводят при 413-443 К и 0,4-0,7 МПа. Реакторы этерификации также расположены каскадом. В них из толуиловой кислоты и монометилтерефталата образуются соответствующие эфиры. Процесс этерификации протекает при 473-523 К. Реакционный поток направляют на дистилляцию, в первой колонне сверху отделяют смесь метанол-вода, а кубовый остаток подают в колонну выделения эфира, работающую под вакуумом. Метилтолуилат и непревращенный п-ксилол направляются в реактор окисления. Далее кубовый остаток, содержащий терефталат, разгоняют под вакуумом для удаления тяжелых фракций, затем он поступает на кристаллизацию под вакуумом 40-50 КПа. На заключительной стадии диметилтерефталат центрифугируют и перегоняют под вакуумом. Выход целевого продукта на исходный п-ксилол составляет ~ 87%. 10.1.3. Процесс фирмы "Aмoкo" Процесс получения ТФК для выработки волокна окислением п-ксилола был предложен "Мид Сенчури Корпорейшн" еще в 1958 г. в США. В настоящее время эта технология синтеза ТФК получила наибольшее распространение. Процесс фирмы "Aмoкo" заключается в окислении п-ксилола в растворе уксусной кислоты воздухом при 448-503 К и 1,5-3,0 МПа в присутствии катализатора (ацетаты кобальта и марганца) и промотора (соединения, содержащие бром, преимущественно бромид натрия):
В этом случае растворители не являются инертной средой, а активно участвуют в процессе окисления. Проведение окисления п-ксилола в среде уксусной кислоты позволяет получить ТФК с большим выходом. В ряду алифатических одноосновных кислот уксусная кислота является наиболее стабильной в условиях реакции окисления, так как не содержит вторичных и третичных С—Н-связей. Она оказывает двоякое действие: сокращает индукционный период вследствие активации катализатора и увеличивает скорость образования и разложения гидропероксидов. Механизм окисления п-ксилола Процесс получения терефталевой кислоты описывается следующими реак-циями:
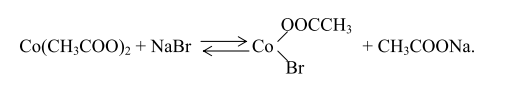
Окисление п-ксилола в среде уксусной кислоты, катализируемое солями кобальта и брома, является радикально-цепной реакцией с вырожденным разветвлением, в котором прослеживается ряд последовательных и параллельных превращений реагентов. В результате обменной реакции ацетата двухвалентного кобальта и бромида натрия образуется бромид ацетата кобальта:
Зарождение цепи в отсутствие катализатора начинается со взаимодействия п-ксилола и молекулярного кислорода по би- или тримолекулярному механизму
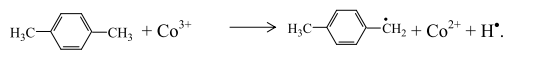
или с катионом металла:
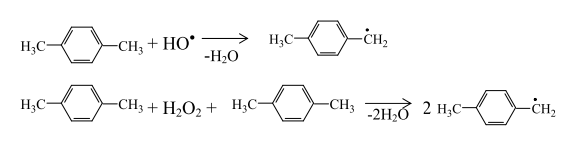
Радикал п-ксилола, присоединяя активированную молекулу кислорода, образует пероксидный радикал:
Вклад реакций некаталитического взаимодействия п-ксилола и молекулярного кислорода в процесс инициирования незначительный. Радикал
который в дальнейшем может подвергаться мономолекулярному распаду с образованием гидроксильных радикалов или в присутствии катализаторов разлагаться по схеме:
Взаимодействие присутствующих в реакционной среде гидроксильного радикала и пероксида водорода с углеводородом может способствовать зарождению новых цепей:
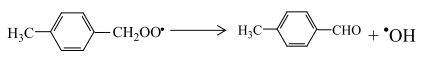
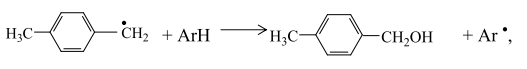
Пероксидный радикал неустойчив и может путем изомеризации превращаться в п-толуиловый альдегид и гидроксильный радикал
или при взаимодействии с углеводородом отрывать от него атом водорода и образовывать гидропероксид и свободный радикал:
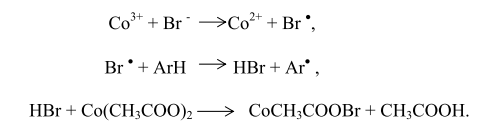
Решающую роль в реакциях продолжения цепей играют соли кобальта. Окисленный кобальт восстанавливается ионами брома с образованием радикалов брома, способных продолжить цепь:
Образовавшийся по реакции
гидропероксид метилбензола при взаимодействии с восстановленным кобальтом последовательно распадается по схеме:
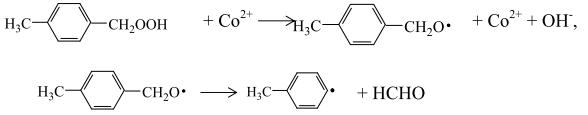
с образованием формальдегида и толильного радикала или радикал СН3С6Н4СН2, присоединяя атом водорода, образовывает п-толуиловый спирт:
п-Толуиловый спирт подвергается дальнейшему окислению молекулярным кислородом
или же при взаимодействии с уксусной кислотой образует эфир:
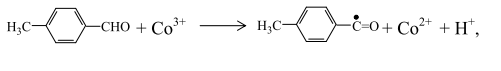
п-Толуиловый альдегид реагирует с катализатором в окисленной форме, восстанавливая его до двухвалентного состояния:
а радикал, получающийся при отрыве водорода от альдегидной группы п-толуилового альдегида, взаимодействия с кислородом, образует пероксидный толуильный радикал:
Пероксидный толуильный радикал, взаимодействуя с углеводородом, об-разует надтолуиловую кислоту и радикал:
Надтолуиловая кислота неустойчива и может последовательно распадаться с участием катализатора:
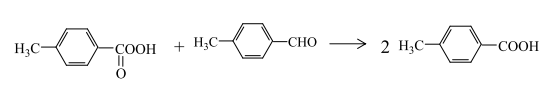
Две последние реакции нежелательны, так как углеводород в итоге при высоких температурах и завышенных концентрациях катализатора подвергается окислительной деструкции. При умеренных режимах ведения процесса, когда надкислота не распадается, превалирует ее реакция с толуиловым альдегидом, при этом образовуется п-толуиловая кислота:
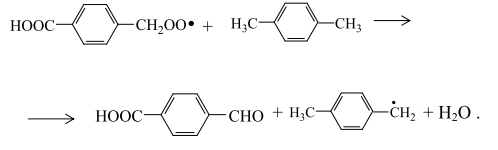
Окисление метильной группы п-толуиловой кислоты осуществляется в основном аналогично окислению метильной группы п-ксилола с участием монобромида двухвалентного кобальта:
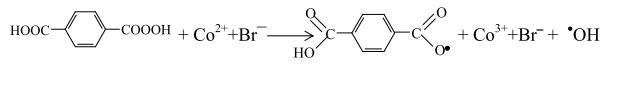
Две последние реакции в отсутствие катализатора и промотора не могут играть существенной роли. Вследствие электроноакцепторного воздействия карбоксильной группы на заместитель в пара-положении его направленное превращение происходит с участием монобромида кобальта:
Мононадтерефталевая кислота взаимодействует с монобромидом кобальта
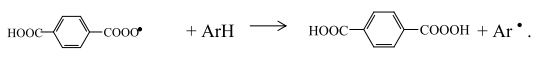
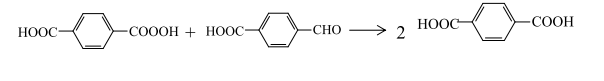
или с п-карбоксибензальдегидом по бимолекулярному механизму с образованием ТФК:
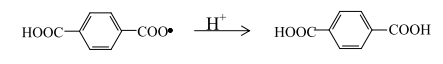
Радикал, полученный по реакции мононадтерефталевой кислоты с монобромидом кобальта, присоединяя водород, также дает ТФК:
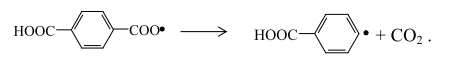
или разлагается по схеме:
В результате рекомбинации свободных радикалов в процессе каталитического жидкофазного окисления п-ксилола и его промежуточных продуктов могут получаться побочные ароматические одно- и многоядерные соединения. Расчетные константы скорости и энергии активации взаимодействия продуктов реакции с ионом Co3+
приведены ниже.
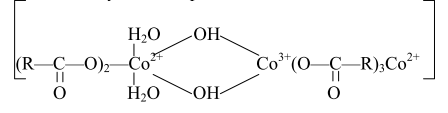
Структуру активного каталитического комплекса, образующегося при окислении п-ксилола в среде уксусной кислоты, включающего ионы Co3+ и Co2+ можно представить следующим образом:
Процесс получения ТФК с использованием кобальтового катализатора проводят в присутствии метилэтилкетона, ацетальдегида и паральдегида. Их роль заключается в образовании с оптимальной скоростью радикалов, которые регенерируют кобальтовый (Co3+) катализатор. Последний необходим для начала окисления промежуточной п-толуиловой кислоты, которая в противоположном случае накапливалась бы в системе. В отсутствие ацетата кобальта образования ТФК не происходит, хотя в системе имеются высокоактивные свободные радикалы СН3СО•. Только при введении ацетата кобальта в результате перехода кобальта в состояние Co3+ начинается образование ТФК. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
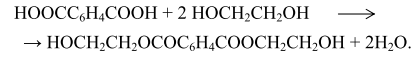
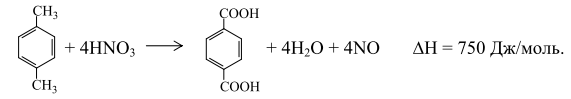
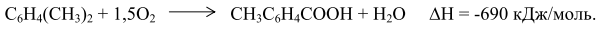
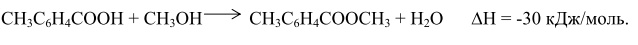
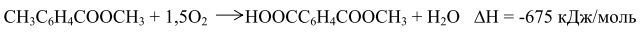
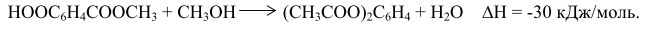
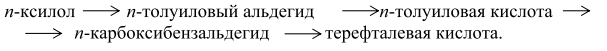
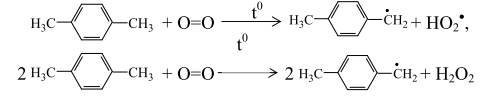
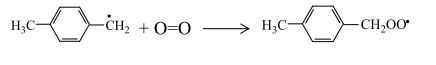
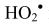 в присутствии небольших количеств воды может образовывать пероксид водорода
в присутствии небольших количеств воды может образовывать пероксид водорода