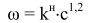|
|
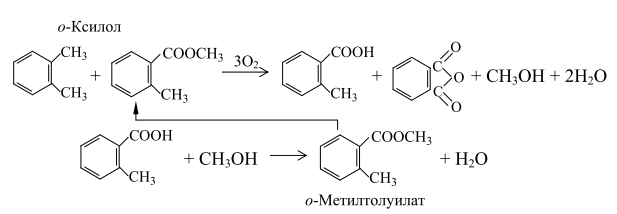
Парофазное окисление о-ксилола или нафталинаОкисление исходных продуктов может проводиться в неподвижном слое катализатора, в трубчатых реакторах, имеющих несколько тысяч трубок. Отвод тепла осуществляется жидким теплоносителем - расплавом солей (нитрит-нитрат) или эвтектической смесью натрия и калия. В качестве катализаторов окисления используют пентаоксид ванадия и диоксид титана (анатаз), имеющие селективность действия 77-83% (мол.). В промышленности применяют катализаторы с большим содержанием пентаоксида ванадия (фирмы "Фон Хейден" и "Вакер хеми") и катализаторы, содержащие до 10% пентаоксида ванадия (фирма БАСФ). В качестве стабилизирующего агента используют фосфор. Окисление проводят при 623-673 К избытком кислорода воздуха при мольном отношении воздух : углеводород между 60 и 120, т.е. ниже нижнего предела области воспламенения. При производстве фталевого ангидрида образуется большое количество газов. Основным методом выделения фталевого ангидрида является десублимация, осуществляемая в теплообменниках с ребристыми трубами, обтекаемыми в поперечном направлении газовой смесью. Таким образом удается собрать 99,5% фталевого ангидрида, находящегося в реакционном потоке. Сырой фталевый ангидрид содержит различные кислоты: фталевую, малеиновую, бензойную. Целевой продукт выделяют дистилляцией под вакуумом. Выход фталевого ангидрида при окислении о-ксилола составляет 75-80%, а при окислении нафталина – 85-88%. При окислении до фталевого ангидрида (процесс "Шервин-Вильямс" нафталин переводится в жидкое состояние, испаряется и вводится в реактор на слой разогретого катализатора. Окисление нафталина кислородом воздуха проводят при 613-658 К. В качестве катализатора применяют оксид ванадия, нанесенный на силикагель. Недостатками парофазных способов являются их взрывоопасность и необходимость работы с большим избытком воздуха, что снижает эффективность использования реакционного объема и создает большие трудности при выделении фталевого ангидрида из реакционной смеси. Проведение же процесса окисления в паровой фазе при высокой температуре (723 К) приводит к сгоранию значительной части сырья и превращению его в побочные продукты, т.е. к снижению выхода целевого продукта и усложнению очистки ангидрида-сырца от примесей. 10.3.2. Жидкофазное окисление о-ксилола или нафталина В конце 1960-х годов в ФРГ был разработан способ получения фталевого ангидрида окислением о-ксилола в растворе уксусной кислоты в присутствии кобальтмарганцевых катализаторов, промотированных соединениями брома. Выход фталевого ангидрида составляет 85%. Однако из-за трудностей в подборе материалов для реактора и холодильников, стойких к парам уксусной кислоты и соединениям брома при высокой температуре, этот процесс не получил широкого распространения. Процесс ВНИИОС Этот процесс получения фталевого ангидрида окислением о-ксилола в жидкой фазе лишен недостатков парофазного и рассмотренного жидкофазного способов. Он обеспечивает селективность по фталевому ангидриду свыше 90%. Процесс ВНИИОС состоит в совместном каталитическом окислении о-ксилола и метилового эфира о-толуиловой кислоты (о-метилтолуиат) кислородом воздуха под давлением. Образующийся при окислении о-метилтолуилата метиловый эфир о-фталевой кислоты при 463 К практически количественно распадается на фталевый ангидрид и метанол. Получающаяся при окислении о-ксилола о-толуиловая кислота этерифицируется метанолом до о-метилтолуилата, который вновь подается на окисление. Процесс может быть описан следующими реакциями:
Процесс включает следующие стадии: - совместное окисление о-ксилола и о-метилтолуилата; - выделение фталевого ангидрида; - этерификация о-толуиловой кислоты метанолом. Процессы окисления о-ксилола и о-метилтолуилата протекают при одинаковых давлении и концентрации катализатора, близких расходах воздуха и описываются кинетическим уравнением:
где ω - скорость окисления сырья, моль/л · с); kн– наблюдаемая константа скорости, л/моль· с); с - концентрация сырья, моль/л; 1,2- порядок реакции по сырью. Совместное окисление о-ксилола и о-метилтолуилата проводят в две стадии. Процесс осуществляют при давлении 1,0 МПа в интервале температур 453-473 К. При проведении процесса по непрерывной схеме наилучшие результаты были получены при использовании реактора полного смешения реагирующих веществ. Кинетические кривые, характеризующие изменение состава оксидата при совместном окислении компонентов в оптимальном режиме, представлены на рис. 10.6.
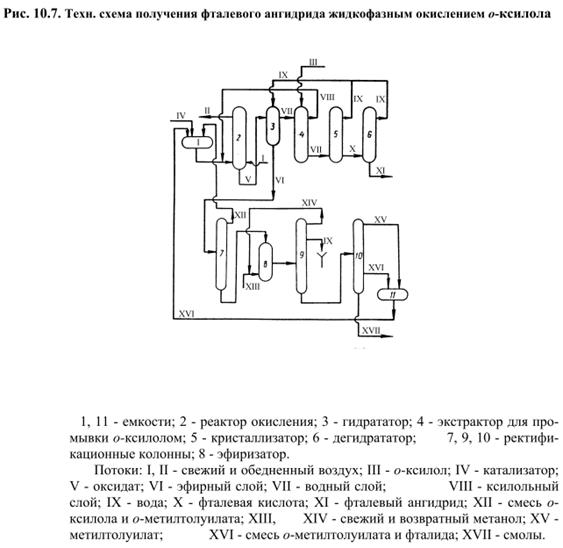
При времени пребывания сырья в зоне реакции 20 мин имели место максимальный выход продуктов и оптимальное соответствие между выходами фталевого ангидрида и о-толуиленовой кислоты. Степень конверсии о-ксилола в о-толуиловую кислоту составляет 56%, а о-метилтолуилата во фталевый ангидрид - 25%. Суммарный выход целевых продуктов – 98%. В результате совместного окисления о-ксилола и о-метилтолуилата получают оксидат сложного состава, содержащий непрореагировавший эфир, о-толуиловую кислоту, фталевый ангидрид, фталид и другие продукты. Фталевый ангидрид из этой смеси выделяют методом гидротации его во фталевую кислоту полуторным избытком воды по отношению к реакционной массе при 373-378 К и 0,12 МПа. Образующаяся фталевая кислота практически полностью растворяется в горячей воде. При охлаждении водного раствора до 313 К из него выделяют фталевую кислоту, которую при 503 К дегидратируют во фталевый ангидрид чистотой 99,9%. Синтез метилового эфира о-толуиловой кислоты осуществляют в условиях некаталитической этерификации при сверхкритических для метанола температуре и давлении. В оптимальных условиях при мольном соотношении кислота:метанол, равном 1:10, конверсия кислоты составляет 98% при селективности 100%. Принципиальная технологическая схема процесса получения фталевого ангидрида жидкофазным окислением о-ксилола представлена на рис.10.7.
Основные показатели паро- и жидкофазного процессов получения фталевого ангидрида приведены в табл. 10.2.
ФУМАРОВАЯ КИСЛОТА
Малеиновая (цис-этилен-1,2-дикарбоновая) и фумаровая (транс-этилен-1,2-дикарбоновая) кислоты
были впервые получены французским химиком Лассенем в 1819 г. дегидратацией яблочной кислоты. В 1919 г. Вейсс и Даунс (фирма "Баррет") показали возможность получения малеинового ангидрида парофазным окислением бензола над пентаоксидом ванадия. Малеиновую кислоту применяют в производстве отверждающихся полимерных материалов, алкидных смол, винной и яблочной кислот. Фумаровую кислоту используют для получения полиэфиров вместо фталевого ангидрида, синтетических высыхающих масел, как заменитель винной и лимонной кислот. Малеиновая и фумаровая кислоты по строению являются цис- и транс-формами. Обе кислоты при отщеплении воды образуют малеиновый ангидрид. Фумаровую кислоту получают изомеризацией малеиновой кислоты. Изомеризация проходит в водном растворе при 378 К в присутствии бромида аммония и персульфата аммония или соляной кислоты. Чистую фумаровую кислоту получают охлаждением реакционной массы и сушкой полученных кристаллов. Малеиновая кислота легко теряет молекулу воды, переходя в ангидридную форму, а фумаровая кислота, в силу своей транс-структуры, теряет воду лишь в жестких условиях. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|