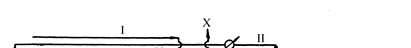|
|
Синтез фенолов через сульфирование бензолаРеакция взаимодействия бензолсульфокислого натрия и едкого натра была открыта А. Вюрцем и А. Кекуле еще в 1867 г.:
Сульфирование бензола осуществляют пропусканием его через концентри-рованную серную кислоту при 423 К. Образующаяся бензолсульфокислота ней-трализуется сульфатом натрия, выделяющимся при щелочном плавлении, или карбонатом натрия: 2CHSOH + NaSO 2CHSONa + SO+ HO (1) 65323 6532 2 608-613 К CHSONa + 2NaOH CHONa + NaSO + HO (2) Окончательную нейтрализацию проводят карбонатом кальция, причем выделяю-щийся СО затем используют для нейтрализации раствора фенолята натрия. Оксид серы (IV) и пары воды, образующиеся по реакции (1), служат для вы-деления фенола из раствора фенолята:
В качестве побочных продуктов образуются гидроксидифенилы, дифенил-сульфон, дифениловый эфир, дифенилсульфид, карбонат натрия, гипс. Достоинством этого способа является простое аппаратурное оформление, чистота получаемого фенола, практически не содержащего серы, и высокий выход продукта – более 90%. Щелочной гидролиз хлорбензола (процесс фирмы "Дау Кемикал") В 1872 г. Дусарт и Барди показали, что при 573 К хлорбензол разлагается водным раствором едкого натра на фенолят натрия и хлорид натрия. Позднее Эйл-сворту удалось осуществить непрерывный процесс гидролиза хлорбензола вод-ным раствором щелочи путем подачи смеси реагентов при 613-663 К через систе-му труб при высоком давлении. Процесс описывается следующими схемами: 2NaCl + 2HO → Cl + 2NaOH + H(электролиз) СH + Cl→CHCl + HCl (хлорирование бензола) 6 62 65 CHCl + 2NaOH → CHONa + NaCl + HO
_________________________________________________________
Реакцию проводят следующим образом: хлорбензол и едкий натр поступают в смеситель, в котором они интенсивно перемешиваются. После этого реагенты подают в автоклав насосами высокого давления. Реакция протекает при 613-663 К и 28,0-30,0 МПа. Модифицированный способ Рашига (процесс фирмы "Хукер Кем") Этот процесс проводят в две стадии. На первой стадии бензол превращается в хлорбензол путем пропускания че-рез него хлорида водорода и воздуха в присутствии хлоридов меди и железа, яв-ляющихся катализаторами:
На второй стадии происходит омыление хлорбензола водяным паром при 773 К в присутствии кремневой кислоты:
Суммарно реакция описывается следующим уравнением:
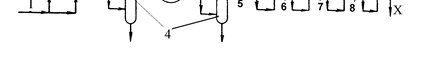
1935-1945 гг. фирмой "Хукер Кем" был освоен промышленный метод полу-чения фенола по способу Рашига. Принципиальная технологическая схема про-цесса представлена на рис. 15.1. Хлорирование бензола проводят в стальном реакторе 4 с воздушным охлаж-дением при 503 К. Для этого бензол нагревают до 563 К и перемешивают горячим воздухом (423 К) с соляной кислотой, нагретой до 383 К. Соотношение бен-зол:воздух:16,5%-ная соляная кислота составляет 10:2,18:3,05 (мас. ч.). Смесь при 783 К подают в реактор 4 для хлорирования, из которого тепло отводят с помо-щью воздушного охлаждения.
Рис. 15.1. Принципиальная технологическая схема получения фенола по cпособу Ра- Шига 1 - холодильник; 2 - смеситель; 3 - разделитель; 4 - реактор хлорирования; 5 - подогреватель; 6 - гидролизный аппарат; 7-11 – аппараты очистки; 12, 13 – аппараты выделения фенола. Потоки: I - бензол; II - соляная кислота; III - хлорбензол; IV - дихлорбензол; V - вода; VI - водный раствор HCl; VII – хлорбензол + вода; VIII – фенол + во- да; IX – бензол + хлорбензол; X - отходящие газы; XI - воздух; XII - фенол; XIII – фенол + хлорбензол + вода + HCl; XIV - полифенилины Катализатор хлорирования получают осаждением оксида алюминия из рас-твора алюмината натрия под воздействием солянокислого раствора CuCl/FeCl 3. Традиционные катализаторы, получаемые пропиткой оксида алюминия хлоридами меди и железа, здесь непригодны. Гидролиз хлорбензола проводят водяным паром при 693 К в присутствии трифосфата кальция. Выход фенола составляет ~ 80% при степени конверсии на каждой из стадий 10-15%. Преимуществами процесса фирмы Хукер" по сравнению со способом Ра- " шига является более высокая селективность, связанная с применением эффектив-ного катализатора. Коррозия аппаратуры предотвращается использованием наряду с керамическими материалами хрома и тантала. Кумольный метод
Оригинальный метод синтеза фенолов кислотным разложением гидроперок-сидов, получаемых окислением жирноароматических углеводородов, был открыт при исследовании получения ацетофенона из гидропероксида изопропилбензола (гидропероксид кумила) П.Г. Сергеевым, Б.Д. Кружаловым и Р.Ю. Удрисом и М.С. Немцовым в 1942 г. и реализован в г. Дзержинске в 1949 г. Промышленное получение фенола указанным способом освоили также фирмы "Геркулес Паудер" (США) и "Дистиллерс" (Англия). Кумольный способ производства фенола занимает в настоящее время веду-щее место. Процесс может быть описан следующей схемой:
O2 + CH=CH-CH AlCl3 CH HCCH
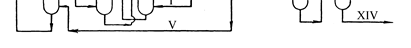
Кислота + CHCO—CH Ацетон COH H 3 CCH 3 Фенол OOH Гидропероксид кумила Принципиальная технологическая схема процесса получения фенола из бен-зола и пропилена представлена на рис. 15.2. Процесс состоит из нескольких ста-дий.
Рис. 15.2. Принципиальная технологическая схема получения фенола из кумола (бен- Зола и пропилена) 1 - реакторы; 2 - аппарат для гидрирования; 3 - концентратор; 4 - аппа- рат для промывки; 5 - колонна выделения ацетона; 6 - колонна выделения кумо- ла; 7 - колонна выделения a-метилстирола; 8 - колонна выделения фенола; 9 - разделитель. Потоки: I – воздух; II – щелочь; III – кумол; IV – вода; V – серная кислота; VI – ацетон; VII – раствор соды; VIII - a-метилстирол; IX – фенол; X – смола
На первой стадии путем алкилирования бензола пропиленом получают ку-мол (изопропилбензол): CHCH + CH—CH=CH 3 CH Хотя для синтеза фенола можно использовать этил-, бутил-, изопропил- и изобутилпроизводные, промышленное значение имеют пока только изопропил-производные. На второй стадии полученный кумол окисляют кислородом или воздухом в достаточно стабильный гидропероксид кумила:
CH [O] CHCH COOH
CH 3CH
Далее гидропероксид кумила концентрируют, поскольку при окислении протекают процессы его распада, которые не позволяют доводить концентрацию в оксидате до значительных величин. И наконец, проводят каталитическое кислот-ное разложение гидропероксида кумила на фенол и ацетон:
CH Н+ O H + CHCCH . COOH
CH 3 О
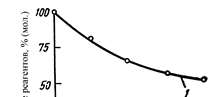
После этого реакционную массу разделяют для получения индивидуальных аце-тона, фенола и выделения побочных продуктов. Алкилирование бензола пропиленом. Алкилароматические углеводороды могут быть получены алкилированием бензола различными алкилирующими агентами: олефинами, спиртами, алкилгалогенидами. Однако спирты и алкилгало-гениды как алкилирующие агенты довольно дороги и при осуществлении крупно-тоннажного производства не перспективны. Поэтому в настоящее время практиче-ское значение имеет только алкилирование олефинами. Катализаторами процесса алкилирования служат протонные и апротонные кислоты: серная и фосфорная кислоты; фосфорная кислота, нанесенная на носи-тель; хлорид алюминия и фторид бора; фтороводородная кислота; цеолиты. При-менение твердых катализаторов значительно упрощает подготовку сырья и осо-бенно переработку реакционной массы: отпадает необходимость в нейтрализации и промывке. В то же время применение хлорида алюминия - наиболее распростра-ненного в настоящее время катализатора - хотя и связано с рядом технологических трудностей (сушка сырья, образование НСl и хлоридов при промывке и нейтрали-зации алкилата), но позволяет обеспечить высокую селективность алкилирования за счет обратимой реакции диспропорционирования полиалкилбензолов в присут-ствии бензола: RR + 2 R Вследствие этого при использовании хлорида алюминия не только умень-шается выход полиалкилпроизводных, но и оказывается возможным перевод в моноалкилбензолы сравнительно небольшого количества образующихся ди- и по-лиалкилбензолов. В Советском Союзе наибольшее распространение получило алкилирование в присутствии AlCl, в США - использование в качестве катализатора фосфорной кислоты на кизельгуре. Алкилирование - сильно экзотермический процесс и при температурах до 473-573 К равновесие практически полностью сдвигается в сторону образования продуктов реакции. Алкилирование ароматических углеводородов является последовательно-параллельным процессом и может протекать вплоть до образования гексазаме-щенных бензолов. На рис. 15.3 представлена зависимость состава реакционной смеси от соот-ношения реагентов. Как видно, увеличениеколичества олефина сдвигает состав продуктов алкилирования в сторону образования дизамещенных бензолов. По-скольку обычно целью процесса является получение моноалкипроизводного, ис-пользуют избыток бензола и поддерживают невысокое содержание монопроиз-водных в реакционной массе – не более 25-35% (мол.).
Рис. 15.3. Зависимость состава реакционной сме- 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|