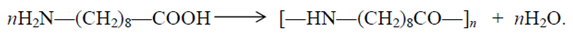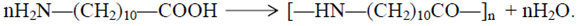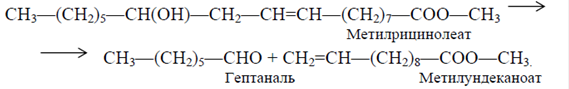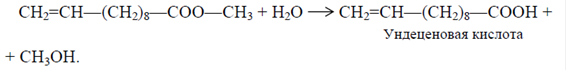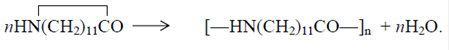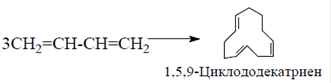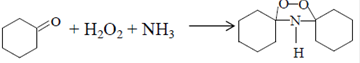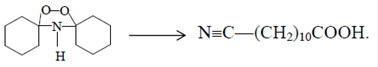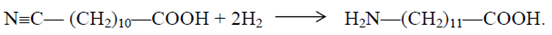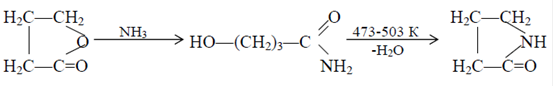|
|
Получение 9-аминононановой кислоты9-Аминононаловая ( аминопеларголовая) кислота является мономером для получения полиамида 9:
Этот полимер по основным свойствам аналогичен полиамиду-6 и полиамиду-7, но менее гигроскопичен. 9-Аминопеларгоновая кислота образуется наряду с аминоэнантовой и аминоундекановой кислотами в процессе теломеризации этилена. Промышленный процесс синтеза 9-аминопеларгоновой кислоты и получения из нее волокна "пеларгон" разработан в Институте элементоорганических соединений АН СССР (г.Москва) в 1950-х годах (Р.Х.Фрейдлина и сотр.).
Получение 11-аминоундекановой кислоты 11-Аминоундекановая кислота является мономером для получения поли-амида-11.
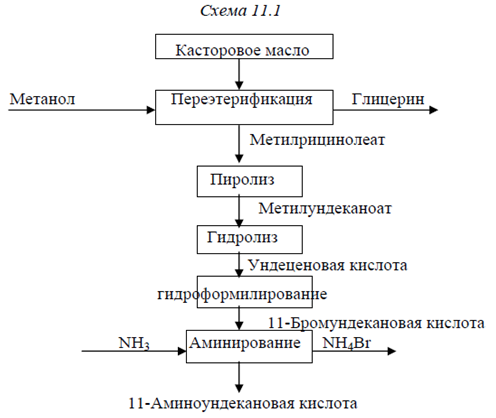
Полиамид-11 несколько уступает обычным полиамидам в прочности, но обладает более высокой эластичностью и гидрофобностью, что делает его пригодным для применения в качестве изоляционного материала, фильтрующих промышленных тканей волокна и трикотажа. Сырьем для получения 11-аминоундекановой кислоты служит касторовое масло, которое представляет собой смесь глицеридов кислот состава: 3-6% насыщенных кислот С16-С18, 3-9% олеиновой, 3-5% линолевой, 3% стеариновой, не менее 80% рицинолевой. Касторовое масло производят в основном в Бразилии и Индии, выделением из семян клещевины прессованием или экстрагируя его органическими растворителями. Процесс получения этой кислоты можно представить следующим образом: глицерид рицинолевой кислоты (12-гидрокси-9-октадеценовой) кислоты – главной составляющей касторового масла – при обработке метанолом превращают в ее метиловый эфир, который расщепляется перегретым паром на гептаналь и метилундеканоат. К последнему после гидролиза против правила Марковникова присоединяется НВr и после аминирования получается 11-аминоундекановая кислота. Схема переработки касторового масла представлена ниже ( схема 11.1).
На первой стадии касторовое масло переэтерифицируют в присутствии избытка метанола, а также метилата натрия в качестве катализатора при 353 К и соотношении метанол:эфир, равном 3:1. Полученный метилрицинолеат отделяется от глицерина при отстаивании. Далее эфир промывают водой для удаления следов глицерина. При времени пребывания ~ 1 ч достигается практически количественный выход целевого продукта. На второй стадии эфир испаряют при 523 К, смешивают с водяным паром при 873 К и смесь вводят в зону пиролиза. Пиролиз осуществляют при температуре 673-848 К при времени пребывания 10 с.
Наряду с метилундеканоатом и гептаналем образуются также метиловые эфиры кислот: линолевой, олеиновой, рицинолевой, стеариновой, пальмитиновой и других, а также несколько процентов насыщенных и ненасыщенных жирных кислот от С14-С18. Метилундеканоат подвергают далее гидролизу до ундеценовой кислоты:
Гидролиз осуществляют при температуре 298 К в присутствии едкого натра. Гидробромирование ундеценовой кислоты проводят с использованием в качестве бромирующего агента НBr, причем реакцию необходимо осуществлять таким образом, чтобы бром присоединился к терминальному (крайнему) атому углерода, т.е. против правила Марковникова. Это достигается путем бромирования в растворителе (толуоле) в присутствии пероксида бензоила как инициатора свободных радикалов. В реактор вводят газообразный бромид водорода. Поскольку эта реакция высоко экзотермичная, температуру в реакторе поддерживают ~ 273 К. 11-Бромундекановая кислота образуется с выходом 95%.
Аминирование бромкислоты происходит согласно схеме
Реакцию проводят при 303 К в присутствии большого избытка водного раствора аммиака. Избыток аммиака удаляют, повышая температуру раствора до кипения.
Получение лауролактама Лауролактам является мономером для получения полиамида-12:
По своим свойствам полиамид-11 и полиамид-12 близки между собой, однако полиамид-12 получают из лауролактама – доступного и дешевого нефтехимического сырья. Именно это обстоятельство делает его вполне конкурентоспособным. Процесс получения лауролактама включает три стадии: тримеризацию бутадиена до 1,5,9-циклододекатриена в присутствии катализатора Циглера-Натта, гидрирование циклододекатриена до циклододекана и превращение циклододекана в лауролактам (аналогично тому, как это происходит в производстве капролактама).
Тримеризация бутадиена В процессе тримеризации бутадиена его можно использовать в виде индивидуального соединения или в смеси с другими компонентами фракции парового крекинга С4 в присутствии катализатора на основе тетрахлорида титана и диэтилалюминийхлорида. В качестве растворителя используют бензол или циклогексан:
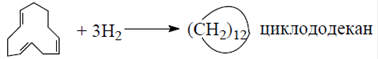
В качестве побочных продуктов образуются винилциклогексен, циклооктадиен и полибутадиен. Селективность по целевому продукту при 90%-ной конверсии составляет 77%. Гидрирование циклододекатриена
является сильно экзотермической реакцией; поэтому ее проводят в жидкой фазе при 473 К и давлении 1,4 МПа в присутствии никелевого катализатора при избытке водорода. Степень конверсии и селективность практически достигают 100%. В промышленности применяют два метода получения лауролактама, в которых в качестве сырья используют циклододекан: процесс фирмы "Хемише Халс" (ФРГ) и фирмы "ATO Хем" (Франция).
Процесс фирмы "Хемише Халс" Этот процесс аналогичен процессу получения капролактама из циклогексана и включает стадии окисления, дегидрирования, оксимирования и перегруппировку Бекмана. Окисление циклододекана проводят в жидкой фазе при 423 К в присутствии борной кислоты. Смесь циклододеканола и циклододеканона получают с выходом 92% при степени конверсии циклододекана 7%. Окисление проводят в серии реакторов с мешалкой. Реакционная смесь из последнего реактора поступает в смеситель, в котором борные эфиры гидролизуются. Борная кислота переходит в водную фазу, затем концентрируется, кристаллизуется и направляется в рецикл. Циклододеканол выделяют ректификацией. Дегидрирование циклододеканола в циклододеканон проводят при ~ 473 К в жидкой фазе в присутствии катализатора – меди, нанесенной на оксид алюминия. Степень конверсии составляет 75% при селективности 98%. Жидкий поток в сепараторе отделяется от водорода и направляется на ректификацию для выделения циклододеканона. Оксимирование циклододеканона осуществляют действием гидроксиламина в растворителе, в качестве которого используют, как правило, изопропилциклогексан при 373 К. В этих условиях достигается практически полная конверсия. Процесс происходит в каскаде реакторов с мешалками. Исходная реакционная смесь включает раствор циклододеканона, водный раствор сульфата гидроксиламина с аммиаком для поддержания рН >7. Органическую фазу после отделения от водного слоя промывают концентрированной серной кислотой. Раствор оксимсульфата направляют на перегруппировку. Перегруппировку Бекмана проводят в реакторах с мешалкой при 383 К в присутствии серной кислоты. При практически количественной конверсии выход целевого продукта составляет 92%. Продукт перегруппировки нейтрализуют аммиаком. Водный слой сульфата аммония экстрагируют бензолом для выделения растворенного в нем лактама. Лауролактам требуемой чистоты выделяют в каскаде из трех ректификационных колонн, работающих под вакуумом. Процесс фирмы "ATO Хем" аналогичен описанному.
Процесс фирмы "Убе" По этому способу лауролактам получается не из циклододекана, а из циклогексанона. На первой стадии циклогексанон превращается в 1,1-пероксидициклогексиламин под действием водорода и аммиака в присутствии аммонийной соли органической кислоты и стабилизатора пероксида – солей цинка и никеля этилендиаминтетрауксусной кислоты:
На второй стадии полученный пероксид пиролизуют при 773 К в присутствии паров воды:
11-Цианоундекановая кислота получается с селективностью ~ 60%. В процессе образуются два основных побочных продукта: циклогексанон, который возвращают на первую стадию, и капролактам. На заключительной стадии проводят гидрирование 11-цианоундекановой кислоты на рутениевом катализаторе, нанесенном на кремнезем, при 373 К под давлением 4,5 Мпа. При этом получают 12-аминоундекановую кислоту:
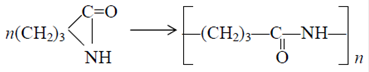
11.1.8. Получение α-пирролидона α-Пирролидон является мономером для синтеза полиамида-4. Полиамид-4 получают анионной полимеризацией пирролидона:
Впервые полиамид-4 был получен Барнсом в 1951 г. путем анионной полимеризации a-пирролидона в присутствии щелочного катализатора. Барнс синтезировал полимер со стабильными конечными группами, высокой молекулярной массой и узким молекулярно-массовым распределением. Это дало возможность вырабатывать из полимера волокно прядением как из раствора, так и из расплава. По своим свойствам полиамид-4 мало отличается от полиамида-6, однако он имеет более высокое влагопоглощение (9,5%), сравнимое с влагопоглощением хлопкового волокна, и более высокую температуру плавления – 523-533 К. Полиамид-4 удачно сочетает в себе свойства синтетических и натуральных волокон, прежде всего высокую прочность (~4,5 г/денье), высокую гидрофильность, хорошую накрашиваемость, низкую электризуемость. Полиамид-4 применяют для изготовления тканей, одежды, трикотажа, белья, автомобильных ковриков, искусственной кожи, упаковочной пленки и т.д. На основе a-пирролидона получают также препараты поливинилпирролидона, обладающие (каждый в своем классе) уникальными характеристиками. Впервые a-пирролидон был получен Шпетом и Линтнером в 1936г. взаимодействием g-бутиролактона с аммиаком при 473-503 К. Реакция в этих условиях протекает до образования g-гидроксибутирамида. При повышении температуры до 503 К происходит дегидратация последнего в a-пирролидон:
Аминирование g-бутиролактона В настоящее время a-пирролидон также получают из g-бутиролактона и аммиака. Процесс осуществляют при повышенной температуре в среде аммиака под давлением или в водном растворе аммиака в отсутствие катализатора, а также в присутствии катализаторов: оксида алюминия, борфосфата, цеолитов, иода и его соединений. Аминирование g-бутиролактона проводят над дегидратирующим катализатором (Аl2О3) в паровой фазе при 523 К в токе аммиака. В результате образуетсяa-пирролидон с выходом не более 50%. Более высокой активностью обладают цеолиты. При 533 К и соотношении парциальных давлений аммиака и g-бутиролактона более 3 селективность процесса по a-пирролидону достигает 90%. Значительно большее практическое значение приобрели процессы некаталитического синтеза a-пирролидона из g-бутиролактона.
Некаталитический синтез a-пирролидона В промышленном масштабе аминирование g-бутиролактона впервые было осуществлено в годы Второй мировой войны в Германии (фирмой БАСФ) и позднее в США и Франции. Разработаны непрерывный и периодический методы получения a-пирролидона. По непрерывному способу технология получения a-пирролидона включает в себя предварительную стадию образования амида g-гидроксимасляной кислоты. Исходные g-бутиролактон и сухой аммиак охлаждают при 258 К в аппарате под давлением. В ходе реакции температура повышается до 313 К, а давление – до 0,8-1,0 МПа. g-Гидроксибутирамид в расплавленном состоянии проходит через систему подогревателей и поступает в вертикальный реактор, в котором при 553 К и давлении 8,0-9,0 МПа дегидратируется в a-пирролидон с выходом 90-95%. По этой схеме аминирования g-бутиролактона работают предприятия фирм "Мицубиси", "Дайниппон Инк." и др.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|