|
|
Критические параметры некоторых веществ
Пример 1.3. Определить количество метана как идеального газа в резервуаре объемом 50 м3 при следующих условиях: температура газа в резервуаре t = 20 °С, манометрическое ( избыточное) давление в резервуаре - 5,1 МПа, абсолютное давление в помещении Р = 99,08 кПа. Решение. Абсолютная температура газа в резервуаре
1 2 3 4 5 Р, МПа
глава 1 Абсолютное давление газа в резервуаре Р = рт + ро = 5,1 + 99,08 -1(Г3 = 5,2 МПа. Удельная газовая постоянная метана r= я /Ц = 8314/16,04 = 518,36 Дж/(кгК). Плотность метана в баллоне 52-Vf K RT v 51§Зб-273Д6 " Количество метана в резервуаре G = p- V- 34,22 • 50 =1711 кг. Технологические характеристики природных газов и их компонентов В природных газах чисто газовых месторождений страны основным компонентом смеси является метан СН4 содержание которого в смеси составляет от 92 до 98% по объему. Остальные 2—8% приходится на «производные» метана — гомологи метана и азота. Как отмечалось выше, кроме чисто газовых месторождений, имеются так называемые газоконденсатные месторождения. Конденсат состоит из легких бензиновых фракций и сжиженных углеводородных газов, обладающих способностью к выпадению из смеси. Кроме двух названных типов газовых месторождений, различают еще понятие нефтепромысловых газов, сопутствующих месторождениям нефти. Содержание метана в таких газах колеблется от 30 до 90% по объему. Этот газ выделяется из нефти, поднимаемой на поверхность, в специальных ловушках-трапах. Обычно в 1 тонне добываемой нефти содержится 200-400 м3 газа при нормальных физических условиях. Теплофизические свойства метана, содержащегося в большом количестве в природных газах, перекачиваемых по газопроводам, практически полностью и определяют свойства природных газов. Метан СН4 - наиболее легкий из углеводородов, плотность его при Характеристика природных газов нормальных физических условиях составляет 0,717 кг/м3. Отношение его плотности к плотности воздуха равно 0,554. Метан - это бесцветный газ, не имеющий запаха. Он нетоксичен, но при большой концентрации в воздухе вызывает удушье. При давлении 0,1 МПа и температуре -162 °С он сжижается. Вслед за метаном в гомологическом ряду идет этан С2Н6 По плотности этот газ близок к воздуху; при давлении 0,1 МПа и температуре 20 °С он может рассматриваться как идеальный газ. В природных газах чисто газовых месторождений содержатся лишь доли процента этана. Увеличение содержания этана в составе природного газа повышает его теплоту сгорания. В соответствии с этим этан является ценным компонентом газообразования топлива. Следующий насыщенный углеводород — пропан С3Н6. Пропан в 1,5 раза тяжелее воздуха. Различие в составе пропана и этана сводится к наличию в молекуле пропана одной группы СН2. Каждый последующий углеводород данного гомологического ряда отличается от предыдущего на одну группу СН2, называемую группой гомологической разности. Пропан содержится в сравнительно незначительном количестве в природных газах чисто газовых месторождений. Значительно больше его содержится в природных газах газоконденсатных месторождений. Пропан легко сжижается. Температура сжижения его при атмосферном давлении равна -43 °С. При снижении давления сжиженный пропан легко испаряется, что позволяет хранить и транспортировать его в сжиженном виде при небольшом давлении, а перед использованием регази-фицировать и сжигать в газообразном состоянии. Бутан С4Н,0- газ, имеющий два изомера - н. бутан и изобутан. Оба изомера при давлении 0,1 МПа легко переходят в жидкое состояние. При этом давлении н. бутан становится жидкостью при температуре -0,5 °С, а изобутан при температуре -10,5 °С. Следовательно, бутан, как и пропан, легко сжижаются и составляют основу сжиженных углеводородных газов. Парциальные давления этана, пропана и бутана очень малы, и в газовой смеси они могут рассматриваться как идеальные газы. Кроме углеводородов, в состав природных газов входят негорючие газы, к которым относятся азот, диоксид углерода, или углекислый газ, и кислород. Азот N2 является двухатомным бесцветным газом, не имеющим запаха и вкуса. Азот практически не реагирует с кислородом, поэтому его рассматривают как инертный газ. В большинстве природных газов его содержание составляет 0,5-3%. Диоксид углерода СО2 является бесцветным тяжелым газом со слегка кисловатым запахом и вкусом. Этот газ не способен к горению. При
высоком содержании углекислого газа в воздухе (5—10% по объему) этот газ вызывает удушье. Содержание диоксида углерода в природном газе обычно не превышает 1% по объему. При давлении 0,1 МПа диоксид углерода, минуя жидкое состояние, переходит в твердое состояние при температуре - 78 °С. Твердый диоксид углерода называют сухим льдом и используют для хранения пищевых продуктов. Кислород О2 является бесцветным газом без запаха и вкуса. Плотность кислорода при нормальных физических условиях равна 1,34 кг/м3. В процессе горения кислород играет роль окислителя. Примесь кислорода в газообразном топливе допускается не более 1 % по объему как по соображениям взрывобезопасности, так и в целях предохранения оборудования от коррозии. Термодинамическое обеспечение решения Энерготехнологических задач трубопроводного Транспорта природных газов В теплотехнических расчетах процессов трубопроводного транспорта газа и определении показателей работы газоперекачивающих агрегатов используется большой набор термодинамических величин: плотность газа, изобарная (Ср) и изохорная (С) теплоемкости, коэффициент Джоуля—Томсона £>h, коэффициент Джоуля—Гей-Люссака Z>u и ряд показателей термодинамических процессов, таких как адиабатический, изоэнтальпийный, изотермический и др. Теплотехнические характеристики природных газов обычно определяют с использованием уравнения состояния и дефференциальных соотношений термодинамики, связывая соответствующие параметры процесса с независимыми переменными уравнения состояния. Определение характеристик природных газов всегда можно полностью осуществить, если исходные параметры позволяют определить удельную работу в рассматриваемом процессе. Действительно, из уравнения первого начала термодинамики для адиабатического процесса (Sg = 0) следует:
= dh + Sm 0, 5со = -dh Для реального газа его энтальпия (h) определяется как функция двух переменных - температуры (t) и давления (Р), h = h(t, Р); для идеальных газов - как функция только одной температуры (/), h = h(t). В связи с этим для реального газа, когда энтальпия h=h(t, P), удельная работа в интегральной форме будет определяться соотношением: Р,), (1.43) где t{ и t2 - начальная и конечная температуры процесса соответственно; pj и Р2 - начальное и конечное давление газа в процессе, соответственно; Dh - коэффициент Джоуля —Томсона или характеристика дроссельного процесса, показывающая изменение температуры газа при изменении его давления в изоэнтельпийном (дроссельном) процессе (h = const). Для идеальных газов эта величина равна нулю и, следовательно, удельная работа по уравнению (1.43) для идеальных газов будет определяться только первым слагаемым правой части: M = Cpm(?2-f,). (1-44) Численные значения коэффициента Джоуля—Томсона для метана приведены в табл. 1.6. Таблица 1.6 Значение коэффициента Джоуля — Томсона (Оь) для метана в зависимости от температуры и давления
Положительное значение коэффициента Джоуля—Томсона характеризует дросселирование большинства природных газов при обычных температурах и давлениях. Поэтому при движении газа через разные сопротивления (регулирующие клапаны, фильтры и т.п.), особенно при резком падении давления, снижается и его температура, что
вызывает обмерзание трубопроводов, запорных, регулирующих и измерительных устройств. Это явление и называют эффектом дросселирования. Следует отметить, что при некоторых условиях, дросселирование сопровождается и нагреванием газа. Коэффициент Джоуля—Томсона в этом случае принимает отрицательное значение. При решении ряда технологических задач, в частности при построении приведенных характеристик центробежных нагнетателей, в расчетах процессов сжатия необходимо располагать скорее не первичными термодинамическими величинами С j Cv, Dh, Du, а их комплексами С Dh, С¥Яи, Л-идр. Использование указанных комплексов не только упрощает проведение расчетов, но и позволяет в каждом конкретном случае выбрать правильный подход к их осреднению в данном процессе, избежать дополнительной ошибки при построении комплекса по осредненным величинам, например С^-Р^и т.д. Комплекс С Db для реальных газов зависит главным образом от температуры. Для природных газов с содержанием метана в диапазоне 90— 100% можно пользоваться следующим эмпирическим уравнением для его определения:
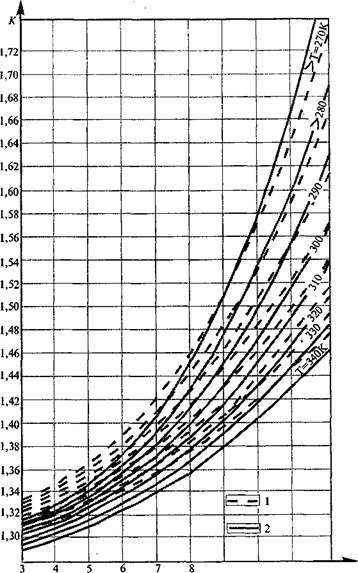
(U7-0,37- где г сн4 - мольное содержание метана в газе, доли единицы. Имея значение С Dh для реальных газов, несложно, определить, например, работу сжатия газа в нагнетателе по уровню (1.43), имея данные о перепаде температур и давлений газа по нагнетателю. На рис. 1.2 —1.5 приведены основные термодинамические величины и комплексы, обычно используемые при проведении теплотехнических расчетов, связанных с транспортом природного газа по газопроводу. Именно поэтому диапазон изменения давлений и температур для них выбран применительно к условиям, характерным для режимов работы магистральных газопроводов. Диаграммы на рис. 1.2 —1.5 построены для двух составов природного газа. Первый состав, отраженный на диаграммах штриховой линией, состоит из метана - 98,6%, пропана - 0,2%, бутана -0,15%, н. бутана - 0,05%, азота - 1%. Газ второго состава, отраженный на диаграммах сплошной линией, содержит метана - 94,36%, этана - 2,2%, пропана -1,2%, н. бутана - 0,5%, н. пентана - 0,2%, азота - 0,7%, кислорода - 0,5%, диоксида углерода - 0,4%. рис. 1.2.Зависимость изобарной теплоёмкости Ср от давления Р и температуры Т для природных газов первого (1) и второго (2) составов
11 Р, МПа Рис.1.3. Зависимость потенциальной функции Pv от давления Р и температуры Т для природных газов первого (пунктир) и второго (сплошная линия) составов Данные по промежуточным составам газов можно получить обработкой соответствующих величин по простейшим интерполяционным зависимостям. Все основные термодинамические характеристики природных газов при различных значениях температур и давлений, характерных для режимов работы магистральных газопроводов приведены в табл. 1.7 и 1.8, в которых Р - давление (МПа), к - показатель адиабаты, z - коэффициент сжимаемости газа, р - плотность газа (кг/м3), h -энтальпия (кДж/кг), Pv - потенциальная функция, равная zR 7'(кДж/кг), Ср - изобарная теплоемкость кДж/(кг °С), Cp£>h - комплекс (кДж/кг • МПа), £>h - коэффициент Джоуля — Томсона (°С/МПа). Рис.1.4. Зависимость величины CpDh от давления Р и температуры Т для природных газов первого (пунктир) и второго (сплошная линия) составов Таблица 1.7 Значение параметров природного газа с содержанием метана 90% в зависимости от давления при средней температуре 293,2 К
Продолжение табл. 1.7
Таблица 1.8 Значения параметров природного газа с содержанием метана 97% в зависимости от температуры при среднем давлении 5 МПа
Рис.1.5. Зависимость показателя адиабаты К от давления Р и температуры Т для природного газа первого (1) и второго (2) составов
Глава 2 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|