|
|
Пиромеллитового диангидридаУсловия Выход, Фирма Катализатор/носитель Сырье реакции % (мол.)
"Когё Гидзуцуин Пентоксид ванадия – Этил- или 673-713 К Токоси" - фосфорный ангидрид/ плав-изопропил- (703-803 К) ленный оксид алюминия псевдо- -1 v = 1000-1500 ч кумол "Когё Гидзуцуин Пентоксид ванадия - оксид мо-Дурол 593 К (703 К) Токоси" либдена/диоксид титана (ана--1 v = 15000 ч таз)
"Когё Гидзуцуин Пентоксид ванадия - оксид мо-Дурол703 К (653 К) Токоси" либдена - фосфорный ангид--1 v = 5000 ч рид/диоксид титана (анатаз) "Когё Гидзуцуин Пентоксид ванадия - фосфор-Дурол713 К (653 К) Токоси" ный ангидрид/диоксид титана -1 v = 15000 ч (анатаз)
"Бергверксфер-Пентаоксид ванадия - оксид бис-633 К банд" молибдена - сульфат калия – Метокси- с = 0,50% (об.) фосфорный ангидрид/ метил-п- α-оксид алюминия ксилол "Принстон Ке-Пентоксид ванадия - оксид мо-Дурол 748 К микл Рисерч" либдена (хромовый ангидрид, оксид серебра, диоксид титана, оксид вольфрама)/карбид крем- ния "Принстон Ке-Пентаоксид ванадия - пентаок-Дурол773 К микл Рисерч" -1 сид ниобия/корунд v = 11 000 ч с=0,15% (об.) 50-70 67,5 32,5 60,5
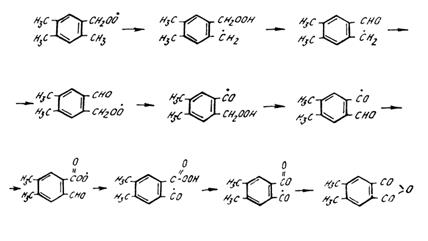
с = 0,11% (об.) "Мицубиси" Пентоксид ванадия - диоксид Ду-673 К (773 К) 69 селена/корунд рол -1 v = 18000 ч с=0,33% (об.) "Мицубиси" Пентоксид ванадия - фосфор-Ду-723 К 73 ный ангидрид - оксид вольфра-рол -1 v = 6000 ч ма/корунд с = 0,33% (об.) "Мицубиси" Пентоксид ванадия - фосфор-Ду-773 К 62 ный ангидрид - оксид молибде-рол -1 v = 6000 ч на с=0,48% (об.) "Мицубиси" Пентоксид ванадия - фосфор-Ду-723 К (788 К) 54,5 ный ангидрид (плавленый ката-рол лизатор) Ниже в виде примера приведен состав смеси продуктов реакции (в %(мас.)), полученной при окислении 82,5%-й дурольной фракции. Содержание, % (мас.) Пиромеллитовый диангидрид …………………………….. ……….96,23 2,4,5-Трикарбоксибензальдегид …………………………... ………...0,09 Метилтримеллитовый ангидрид ………………………….. ………...0,66 Тримеллитовый ангидрид …………………………………. ………...1,25 4,5-Диметилфталевый ангидрид ………………………….. ………...1,26 2,5-Диметилтерефталевая кислота + 2,4-диметилизо-фталевая ки- слота …………………………………………... ………...0,03 4-Формил-2, 5-диметилбензойная кислота ………………. ………...0,06 2,5-Диметилтерефталевый диальдегид …………………... ………...0,02 4-Метилфталевый ангидрид ………………………………. ………...0,16 Фталевый ангидрид ………………………………………... ………...0,03 Дуриловая кислота ………………………………………… ………...0,03 Дуриловый альдегид ………………………………………. ………...0,03 Дурохинон ………………………………………………….. ………...0,03 Бензойная кислота …………………………………………. ………...0,03 Кроме того, в смеси продуктов присутствуют более высокомолекулярные смо-листые вещества. Особенностью строения молекулы дурола является соседство метильных групп, расположенных в пределах расстояний, допускающих их внутримолеку-лярное взаимодействие с перемещением атомов водорода из одной боковой цепи в другую. При этом окисление одной группы облегчает вступление в реакцию со-седней метильной группы. На оксиднованадиевом катализаторе при температуре процесса протекает реакция дегидрирования дурола с образованием достаточно устойчивого дурильного ради-кала С6Н2(СН3)·, который затем с получением - 3СН2присоединяеткислородперок сидного дурильного радикала С62СН33СН2ОО·. Егодальнейшеепревращение Н()
сопровождается переносом атомов водорода из одной боковой группы в другую:
[O] -H2O -H2O Другое направление может быть связано с процессами внутримолекулярной циклизации промежуточных кислородсодержащих соединений в 5-членные струк-туры на стадиях, предшествующих появлению карбоксильных групп. Ангидрид-ные группировки формируются при этом путем окисления метиленовых групп 5-членных циклов, минуя стадии образования подверженных декарбоксилированию свободных карбоновых кислот:
Присутствие в продуктах реакции ангидрида тримеллитовой кислоты и фтале-вого ангидрида может быть следствием как деалкилирования исходного дурола, так и других деструктивных процессов, например декарбоксилирования и декар-бонилирования соответствующих кислот и альдегидов. Наличие в молекуле дурола нескольких реакционноспособных участков обу-словливает многообразие направлений его окисления. Предполагается, что основ-ная реакция протекает в направлении: дурол 4,5-диметилфталан 4,5-диметилфталид 4,5-диметилфталевый ангидрид пиромеллитовый диангидрид малеиновый ангидрид СО + СО2 Пиромеллитовый диангидрид может быть получен окислением дурилен-гликоля. Основными продуктами процесса являются пиромеллитовый диангид-рид, ангидриды цитраконовой и малеиновой кислот, формальдегид, оксиды угле-рода.При парофазном окислении октагидроантрацена также образуется пиромел-литовый диангидрид с выходом ~ 90% (масс.). В качестве катализатора использу-ют пентаоксид ванадия. Жидкофазное окисление дурола.При жидкофазном окислении дурола в качестве окислителей применяют азотную и хромовую кислоты, перманганат ка-лия, хлор, сернистый ангидрид, воздух, кислород и др. Поскольку жидкофазное окисление проводят в водных растворах, первичными продуктами превращения любого сырья является пиромеллитовая кислота, которая далее подвергается очи-стке и последующей обработке для перевода ее в диангидрид При использовании в качестве окислителя воздуха или кислорода не проис-ходит полного превращения метильных групп дурола в карбоксильные группы и для получения пиромеллитовой кислоты необходимо доокисление продукта пер-вой стадии азотной кислотой или другими окислителями в сравнительно жестких условиях. Впервые процесс жидкофазного окисления дурола азотной кислотой разработала фирма "Дюпон". На первой стадии в мягких условиях окисления об-разуется дуриловая кислота, которую на второй стадии переводят в пиромеллито-вую кислоту при повышенных давлениях и температуре. Несмотря на высокий выход пиромеллитовой кислоты, метод окисления азотной кислотой имеет ряд недостатков: - образование большого количества промежуточных продуктов, разделение которых затруднено; - образование большого количества (до 10%) нитропроизводных, что приво-дит к окрашиванию продукта; - образование взрывоопасных соединений; - разрушение аппаратуры под действием коррозии; - сложная схема процесса, связанная с необходимостью регенерации азотной кислоты. Однако вследствие более высоких выходов целевого продукта, процесс окисления азотной кислотой успешно конкурирует с процессом парофазного окисления. Разработан также промышленный вариант производства пиромеллитового диангидрида окислением дурола кислородом воздуха в присутствии катализато-ров: ацетатов кобальта, солей церия. В качестве инициаторов окисления исполь-зуют бромид натрия и тетрабромэтан. Окисление протекает в среде уксусной ки-слоты при температурах 410 - 505 К. Недостатком описанного метода является высокотемпературная коррозия реактора агрессивной реакционной системой, со-держащей бром, азотную кислоту и пиромеллитовую кислоту. Для повышения выхода пиромеллитовой кислоты и уменьшения образования нитропродуктов раз-работан двухстадийный способ получения пиромеллитовой кислоты. На первой стадии дурол окисляют воздухом под давлением 1,5 МПа при 438-443 К в присут-ствии стеарата кобальта до получения оксидата с кислотным числом 250-300. На второй стадии оксидат дурола доокисляют 17-20%-ной азотной кислотой при 468-478 К и давлении в титановом автоклаве 2-3 МПа. Продолжительность окисления на первой стадии 2-3 ч, на второй- 1,5-2 ч. Выход пиромеллитовой кислоты со-ставляет 80-85%. При жидкофазном окислении дурола получают пиромеллитовую кислоту, которую следует перевести в диангидрид. Жидкофазное окисление осуществляют азотной кислотой в две стадии: на первой - получают дуроловую кислоту оксиле-нием кислородом воздуха при 1,5 МПа и 433-443 К в присутствии стеарата ко-бальта, на второй - 17-20%-ной азотной кислотой доокисляют дуриловую кислоту при 1,96-2,94 МПа и 468-478 К. Выход пиромеллитовой кислоты достигает 80-85% (мол.) т.е. выше, чем в любом другом процессе. В двухстадийном процессе не образуются нитропроизводные дурола, так как дуриловая кислота нитруется с трудом. Газофазное окисление дурола. Газофазное окисление дурола воздухом при 623-773 К, концентрации дурола в дуроло-воздушной смеси 0,1-0,5%, объемной нагрузке катализатора по дуроло-воздушной смеси 6 000 – 18 000 ч-1 приводит не-посредственно к образованию пиромеллитового диангидрида с выходом 65-75 %. При окислении дуролсодержащих фракций степень использования дурола (выход диангидрида) возрастает по мере снижения его концентрации во фракции: Содержание Выход пиромеллитового Производительность ка- дурола во фракции, % диангидрида, % тализатора, г/л3 (кат.)·ч 99,7 66,6 82,0 96,0 71,8 84,8
Окисление псевдокумола.Пиромеллитовый диангидрид получают в лаборатор-ных условиях путем окисления псевдокумола по видоизмененному методу Мил-лса и Клара. Сначала взаимодействием псевдокумола и ацетилхлорида получают ацетилпсев-докумол с выходом 90% от теоретического. HCCH HC CH 33CH3COCl33
AlCl3HCCOCH HC Далее ацетилпсевдокумол окисляют гипобромитом натрия с образованием дури-ловой кислоты:
HCCH HCCH 33NaOBr33
HCCOCHHCCOOH Затем дуриловую кислоту окисляют щелочным раствором перманганата калия при 623-633 К до пиромеллитовой кислоты: HCCH HOOCCOOH 33KMnO4
HCCOOHHOOCCOOH И наконец, нагреванием в вакууме (остаточное давление 10 Па) при 498-513 К пи-ромеллитовую кислоту превращают в диангидрид:
HOOCCOOH OCCO OO HOOCCOOH CO OC

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|

 ·
·