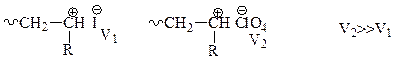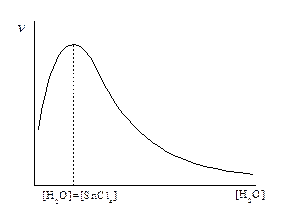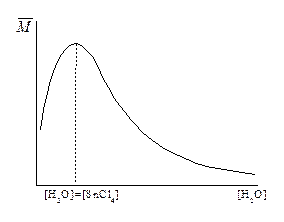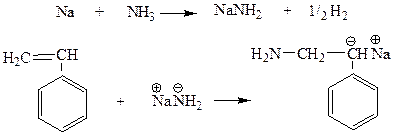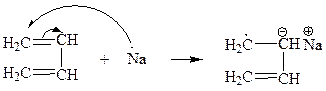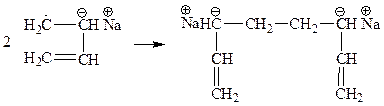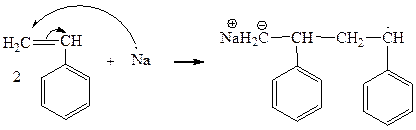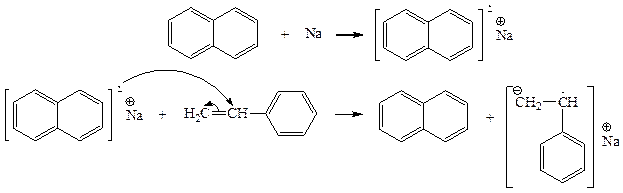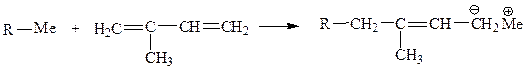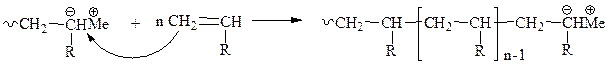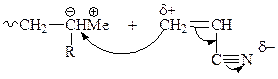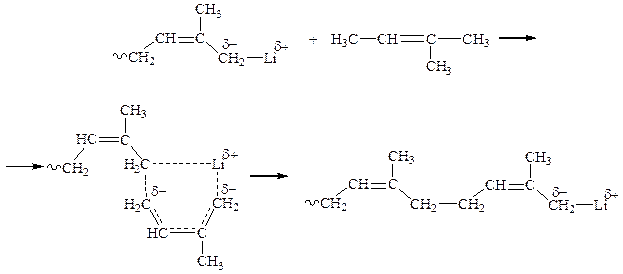|
|
Кинетика катионной полимеризацииНесмотря на большое разнообразие и сложность процессов КП, некоторое общее представление о кинетических особенностях можно получить, если допустить, что скорость процесса образования макромолекулы складывается из скоростей четырех основных стадий: инициирование vин, роста цепи vр, ограничение роста цепи путем обрыва vобр и передачи цепи на мономер vпер (основной способ обрыва цепи). Упрощенные уравнения скоростей элементарных стадий можно представить в следующем виде:
Допустив установление равновесного состояния, когда vин= vобр, можно вычислить концентрацию vин= vобр или
Суммарная скорость процесса vобщ, т.е. скорость убывания мономера, иожет быть выражена уравнением скорости роста цепи:
Подставив в уравнение (6) значение
При Это соотношение не отражает влияние температуры и природы среды, которое распространяется не только на состав активного центра, но и на характер всех реакций. Средняя степень полимеризации:
Из уравнения (8) следует, что степень полимеризации не зависит от концентрации катализатора, в отличии от ЦРП. Если скорость передачи цепи намного выше скорости обрыва при Если же при
Влияние различных факторов на кП Влияние природы растворителяобъясняется тем, что процесс полимеризации связан с образованием и диссоциацией ионных пар:
Степень участия каждого из указанных состояний определяется не только полярными свойствами растворителя, но также природой мономера, противоиона и другими факторами. Полярные растворители сольватируют растущие макрокатионы и способствуют смещению равновесия в сторону образования сольватно-разделенных пар, которые более реакционноспособны, чем контактные пары. Пример: влияние диэлектрической проницаемости растворителя на молекулярную массу и скорость полимеризации α-метилстирола:
Сольватирующая способность растворителя также влияет на кинетику полимеризации, т.к. растворитель может изменить активность реакционного центра. Например, КП стирола в среде нитротолуола протекает с достаточной скоростью, а в среде этанола не идет, хотя диэлектрические проницаемости этих растворителей близки. Увеличение скорости КП и молекулярной массы под действием некоторых хлорсодержащих растворителей объясняется их участием в КП как сокатализаторов.
Влияние противоиона. Чем меньше размеры противоиона и чем больше его нуклеофильность, тем более прочна его связь с реагирующим макрокатионом, и тем сложнее внедрение мономера в цепь. Например: скорость полимеризации стирола в CH2Cl2 в присутствии HClO4 выше, чем в присутствии I2, т.к. размеры I- меньше размера ClO4-.
Влияние температуры. С понижением температуры скорость процесса уменьшается. Однако, при этом возрастает диэлектрическая проницаемость среды и уменьшается влияние противоиона на процесс, что может привести к повышению константы реакции роста цепи. КП обычно проводят при температурах порядка -50÷-70 0С, в некоторых случаях ниже. Например, ПК изобутилена при -100 0С в присутствии катализаторов AlCl3 или BF3 заканчивается за несколько секунд с образованием полимера с молекулярной массой в несколько миллионов.
Влияние примесей. При малых концентрациях примеси выполняют роль сокатализаторов и способствуют увеличению скорости полимеризации. При больших количествах они участвуют в реакциях ограничения роста цепи, снижают молекулярную массу и скорость реакции. Например: влияние концентрации воды на полимеризацию стирола в присутствии SnCl4.
Анионная полимеризация По анионному механизму полимеризуются: 1. виниловые мономеры, содержащие электроноакцепторные заместители; 2. гетероциклы (лактамы, оксиды, лактоны, силоксаны и др.) Далее рассмотрим ряд по уменьшению активности наиболее часто полимеризуемых по анионному типу мономеров:
Катализаторы АП Щелочные металлы: Li, Na, K, Rb, Cs. Амиды, гидриды, органические соединения металлов I и II группы.
Механизм АП I Инициирование АП Существует несколько механизмов инициирования – образования активных центров: 1. Присоединение свободного аниона к молекуле мономера реализуется при использовании щелочных металлов или их амидов в среде жидкого аммиака, аммиак выполняет также роль агента передачи цепи:
2. Перенос электрона от катализатора на мономер происходит в слабополярных средах. Например получение Na-бутадиенового каучука:
Образовавшиеся анион-радикалы рекомбинируют с образованием бианиона, который может расти в двух направлениях:
В этих условиях виниловые мономеры образуют ион-радикалы при двух молекул мономера с щелочным металлом:
3. Перенос электрона с инициирующего аниин-радикала на мономер. Имеет место при использовании металлических производных полициклических углеводородов, которые являются переносчиками электронов. Эта реакция протекает в полярных растворителях:
4. Присоединение молекулы катализатора по двойной связи мономера. Осуществляется при использовании алкилов щелочных металлов R-Me:
II Рост цепи В большинстве случаев как и при КП представляет собой ряд актов присоединения мономера к активному центру за счет внедрения молекулы мономера между растущим макроаниионом и противоионом, чаще всего металлом.
В случае бианионов присоединения молекулы мономера происходит по обоим концам, заряженным отрицательно. Присоединение молекул мономера идет достаточно регулярно, по типу α, β или «голова к хвосту», поскольку присоединяющиеся молекулы ориентируются под влиянием ионной пары:
Однако стереорегулярность при этом достигается редко. Полимеризация в присутствии литийорганических соединений в малополярных растворителях позволяет получать стереорегулярные полимеры. Например при АП изопрена образуется полимер, содержащий 93-94 % цис-звеньев. Направленное присоединение мономера в этих условиях обусловлено образованием устойчивого шестичленного комплекса мономера с ионной парой, в котором мономер имеет цис-конфигурацию:
Образование такого комплекса обусловлено тем, что литий имеет среди щелочных металлов наименьший ионный радиус и самый высокий потенциал ионизации. Поэтому связь C-Li имеет наименьшую полярность и эта связь сохраняется и в переходном комплексе. Чем выше устойчивость комплекса, тем выше стереорегулярность образующегося полимера.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|
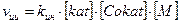 (1)
(1)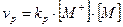 (2)
(2) (3)
(3)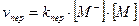 (4) основной способ
(4) основной способ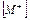 :
: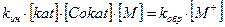
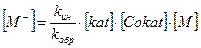 (5)
(5)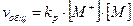 (6)
(6)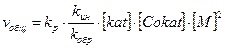 (7)
(7)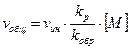
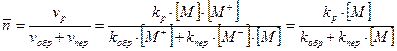
 (8)
(8)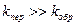 , то молекулярная масса не зависит от концентрации мономера, т.к.
, то молекулярная масса не зависит от концентрации мономера, т.к.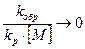
 или
или 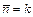
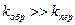 , то молекулярная масса пропорциональна концентрации мономера, т.к.
, то молекулярная масса пропорциональна концентрации мономера, т.к.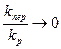
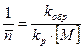 или
или 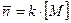
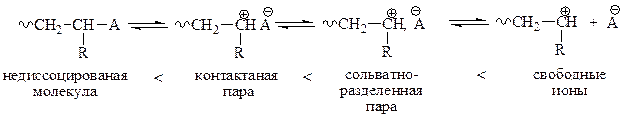 активность растет в этом ряду
активность растет в этом ряду