
|
|
Краткие теоретические сведенияМинеральные удобрения необходимы для питания растений и используются для получения высоких и устойчивых урожаев. Наиболее широко в сельском хозяйстве используются азотные, фосфорные и калийные удобрения. Азотные удобрения подразделяются на следующие классы: 1) аммиачные, содержащие азот в форме катиона (сульфаты аммония и фосфаты аммония); 2) нитратные, содержащие азот в форме аниона (нитрат кальция, нитрат натрия и нитрат калия); 3) аммиачно-нитратные, содержащие азот в катионе и анионе (аммиачная селитра); 4) амидные, содержащие азот в форме – NH2 (мочевина). Азот необходим для роста растений и входит в состав всех белков, витаминов и т. д. При взаимодействии аммиака с кислотами или гидроокисей металлов с азотной кислотой образуются азотные удобрения. Аммиачная селитра получается путем нейтрализации 50–60%-го раствора азотной кислоты газообразным аммиаком: HNО3 + NH3 =NH4NO3 + 148,6 кДж В промышленности теплоту реакции используют для испарения воды и концентрирования раствора аммиачной селитры в аппаратах ИТН(использование теплоты нейтрализации). Нитрат аммония – безбалластное твердое удобрение, содержащее 35 % азота в аммиачной и нитратной формах, благодаря чему может применяться на любых почвах и для любых культур. Но нитрат аммония имеет неблагоприятные физические свойства. Кристаллы его хорошо растворимы в воде и очень гигроскопичны, поэтому на воздухе быстро расплываются и слеживаются в крупные агрегаты. Кроме того, при изменении температуры и влажности воздуха при хранении нитрата аммония происходят полиморфные превращения, т. е. переход кристаллов из одной кристаллической формы в другую. Эти явления ведут к разрушению кристаллов и слеживанию их в монолитную массу. Наиболее эффективный прием борьбы со слеживаемостью нитрата аммония – введение добавок, подавляющих полиморфные превращения при изготовлении удобрения, – фосфата и сульфата аммония, нитрата магния и других. Для уменьшения слеживаемости применяют опрыскивание гранул удобрения растворами поверхностно-активных веществ (ПАВ), повышающих гидрофобность гранул и опудривание их порошками малогигроскопичных веществ: каолином, талько-магнезитом, фосфоритной мукой.
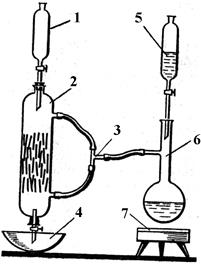
Порядок выполнения работы Аммиачную селитру можно получить в приборе, представленном на рисунке 2.10.1. Здесь реакционным аппаратом служит стеклянная трубка диаметром 50–60 мм и высотой 300–400 мм с припаянными внизу и вверху отводами для присоединения колбы Вюрца. Верхний и нижний концы трубки оттягивают. В нижнюю часть трубки укладывают стекловату и на нее насыпают стеклянную насадку, в верхнюю – вставляют на пробке капельную воронку. Вместо трубки можно использовать кожух водяного холодильника, но при этом необходимо, чтобы отводы, особенно нижний, были загнуты кверху во избежание попадания растворов в шланги, по которым поступает аммиак. Аммиак подается из колбы Вюрца, где он образуется либо за счет осторожного нагревания его концентрированного раствора, либо за счет реакции хлорида аммония с гашеной известью. Перед началом работы проверяют концентрацию азотной кислоты и аммиака. С этой целью их растворы осторожно наливают в цилиндры и при помощи ареометров определяют плотность. Затем по справочнику находят процентное содержание азотной кислоты и аммиака в их растворах. Оно должно быть 48–60 % для азотной кислоты и не менее 25 % для раствора аммиака. После этого по заданию преподавателя 15–20 мл азотной кислоты наливают в капельную воронку, а в колбу Вюрца 75–100 мл раствора аммиака. Колбу Вюрца закрывают пробкой и нагревают на закрытой электроплитке. После того как аммиак начинает поступать в нейтрализатор, открывают кран капельной воронки и медленно, по каплям пропускают через нейтрализатор азотную кислоту. Образующаяся в виде белого тумана аммиачная селитра конденсируется и непрерывно стекает в нижнюю часть реактора и оттуда в предварительно взвешенную фарфоровую чашку. Закончив приливать кислоту, закрывают кран капельной воронки и продолжают еще несколько минут пропускать аммиак. Затем проверяют кислотность раствора аммиачной селитры лакмусовой бумажкой. Если раствор имеет кислую реакцию, то его переливают в капельную воронку и снова пропускают через нейтрализатор, не прекращая подачу аммиака. Эту операцию осуществляют до появления щелочной реакции раствора. После этого прекращают подачу аммиака из колбы Вюрца, ополаскивают капельную воронку 3–4 раза порциями дистиллированной воды по 5 мл и промывают этими порциями нейтрализатор. Промывные воды присоединяют к раствору аммиачной селитры и ставят фарфоровую чашку с раствором на песчаную баню. Помешивая раствор стеклянной палочкой, упаривают его до появления белых паров, при этом температура плава достигает 433 °К. После охлаждения и кристаллизации аммиачной селитры взвешивают чашку и, высчитав массу полученной селитры, определяют ее выход в процентах, исходя из количества взятой азотной кислоты. Результаты работы оформляют в виде таблицы: Таблица №2.9
Анализ аммиачной селитры на содержание аммонийного азота Оборудование и реактивы: установка для получения аммиачной селитры (рис. 2.10.1) мерный цилиндр на 500 мл, ареометры для измерения плотности растворов азотной кислоты и аммиака, песчаная баня, фарфоровая чашка, раствор азотной кислоты (48–60 %), раствор аммиака (25 %), лакмусовая бумага.
Рис. 2.10.1. Установка для получения аммиачной селитры: 1 и 5– капельные воронки; 2 – реактор; 3 – тройник; 4 – фарфоровая чашка; 6 – колба Вюрца; 7 – электроплитка
Наиболее удобным, хотя и приблизительным, способом определения аммонийного азота считают формальдегидный метод. При взаимодействии формальдегида с аммиачной селитрой образуется гексаметилентетрамин и выделяется азотная кислота, которая оттитровывается раствором щелочи: 4NH4NO3 + 6НСОН ® C6H12N4 + 4HNO3 + 6Н2O Ход работы. Взвешенную с точностью до 0,0002 г массу навески 1,5–2,0 г соли помещают в мерную колбу на 250 мл и растворяют в дистиллированной воде, доводят раствор до метки и тщательно перемешивают. После этого 50 мл раствора формальдегида (40 %-й) переносят в коническую колбу на 100–150 мл, прибавляют 3—5капель фенолфталеина и нейтрализуют раствором гидроксида натрия концентрации 0,1 моль/л до появления розовой окраски. Раствор соли (25 мл) переносят в коническую колбу на 250 мл, добавляют несколько капель фенолфталеина и, если реакция кислая, нейтрализуют 0,1 моль/л раствором гидроксида натрия. К этому раствору соли добавляют 10 мл нейтрализованного раствора формальдегида, 3–5 капель фенолфталеина, перемешивают и после 1–2 мин выдержки оттитровывают раствором гидроокиси натрия концентрации 0,1 моль/л до слабо-розовой окраски. Определяют содержание NH4NO3 в соли по формуле:
где V – объем раствора гидроксида натрия 0,1 моль/л, израсходованного на титрование, мл; 0,008 – масса нитрата аммония в г, соответствующая массе гидроокисида натрия, содержащегося в 1 мл ее раствора концентрации 0,1 моль/л; т– масса навески соли, г. Содержание аммонийного азота (%) определяют по формуле:
где V – объем раствора гидроксида натрия, израсходованного на титрование, мл; 0,0014 – масса аммонийного азота (г), соответствующая массе гидроокиси натрия, содержащегося в 1 мл 0,1 моль/л раствора; т – масса навески соли, г. Результаты анализа оформляют в виде таблицы:
Контрольные вопросы 1. Каковы особенности процесса получения аммиачной селитры, влияние выделяющейся теплоты на ход процесса и ее использование в производстве? 2. Как предотвращают слеживаемость нитрата аммония?
Список литературы 1. Тихвинская М. Ю.Практикум по химической технологии / М. Ю. Тихвинская, В. Е. Волынский. – М. : Просвещение, 1984. – 160 с. 2. Кононов А. В. . Основы технологий комплексных удобрений / А. В. Кононов, В. И. Стерлин. – М. : Химия, 1988. – 319 с. 3. Позин М. Е. Технология минеральных удобрений. – Л. : Химия, 1989.
ЛАБОРАТОРНАЯ РАБОТА «ПОЛУЧЕНИЕ ГИДРОКСИДА НАТРИЯ КАУСТИФИКАЦИЕЙ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
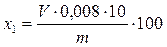 %
% ,
,