|
|
Методика проведения работыПодготовка образцов к покрытию заключается в обезжиривании их поверхности и травлении для лучшего сцепления покрытия споверхностью. Несколько образцов (в соответствии с полученным заданием) в виде железных пластинок нумеруются и обезжириваются в течение 15–20 минут при 90–95°С в растворе, содержащем 100 г/дм3едкого натра, 40 г/дм3кальцинированной соды и 20 г/дм3фосфата натрия. После промывки в горячей и холодной воде образцы подвергают травлению в течение 5–10 минутв растворе, содержащем 100 г/лсерной и 20 г/л соляной кислот. После промывки в холодной воде подготовленные к фосфатированию образцы хранятся в 3%-ом растворе соды. Фосфатирование образцов производится в термостате при заданных условиях. В термостат помещается ванна для фосфатирования — стакан, заполненный раствором мажефа или цинкофосфатного концентрата, в который погружаются испытуемые образцы. Образцы подвешивают в ванне таким образом, чтобы часть пластинки осталась непогруженной в раствор. Продолжительность и температура фосфатирования отдельных образцов задаются преподавателем. После фосфатирования образцы промывают водой, сушат при помощи фильтровальной бумаги и испытывают на коррозионную стойкость.
Испытание защитных свойств фосфатной пленки На поверхность образца при помощи капельницы наносят на некотором расстоянии одна от другой две-три капли раствора, который готовят, смешивая 40 см3 0,8 н раствора медного купороса, 1–5 см3 0,1 н раствора соляной кислоты; 20 см3 10%-го раствора поваренной соли. Одновременно включают секундомер и наблюдают момент изменения цвета пластинки под каплей (покраснение вследствие выделения меди). Время (мин) между нанесением капли на фосфатированную поверхность металла и моментом изменения цвета капли от серо-голубого до желтого или красного служит характеристикой коррозионной стойкости фосфатной пленки. В соответствии сполученными данными стойкость фосфатных покрытий принято оценивать следующим образом: 1) 5 мин и более – высокая стойкость; 2) от 2 до 5 мин – средняя стойкость; 3) от 1 до 2 мин – пониженная стойкость; 4) менее 1 мин – низкая стойкость. Для сравнения наносят одну каплю этого же раствора на незащищенную фосфатным покрытием поверхность образца, а также отмечают момент начала выделения меди – покраснения под каплей. Полученные в результате проведения работы данные заносят в таблицу по форме:
Инструкция к лабораторной работе «Фосфатирование металлов» 1. Приготовление цинкофосфатного концентрата. В стакан, содержащий 100 мл раствора вымороженной азотнокислотной вытяжки, вводим 12 г семиводного сульфата цинка, разбавленного в небольшом объеме воды, и перемешиваем стеклянной палочкой. Выпавший в осадок сульфат кальция отфильтровываем через воронку Бухнера, а полученный фильтрат разбавляем в 10 раз и определяем в нем содержание азотной и фосфорной кислот до фосфатирования металла. (Вымороженная азотнокислотная вытяжка является дешевым продуктом разложения апатита или фосфорита азотной кислотой в производстве получения фосфорной кислоты.) 2. Подготовка образцов – нумерованные железные пластинки готовят к фосфатированию обезжириванием в щелочном растворе и травлением в растворе кислот. После промывки водой хранить образцы в растворе соды. Брать образцы при дальнейшей работе только металлическими щипцами. 3. Травление образцов кислотами производить под тягой в защитных очках и перчатках, соблюдая правила обращения с кислотами, изложенные в специальной инструкции. Сливать раствор кислот после травления в специальную емкость, снабженную соответствующей надписью (находится под тягой). 4. Фосфатирование. Подготовленные образцы подвергнуть фосфатированию в заданных условиях, погружая их в ванну с раствором мажефа или цинкофосфата, находящуюся в термостате. 5. Промывка. После фосфатирования промыть образцы водой, высушить фильтровальной бумагой и испытывать на коррозионную стойкость в соответствии с заданием.
Контрольные вопросы 1. На чем основан процесс фосфатирования? 2. Каков химизм процесса фрсфатирования?
Список литературы 1. Мухленов И. П. Основы химической технологии. – М. : Высш. шк., 1983. – 335 с, 2. Чумаевский В. А. Активаторы в процессе фосфатирования металлов / В. А. Чумаевский, Т. М. Краснова // Химич. Промышленность. – 1990. – № 6. – С. 18–19. 3. Хаин И. И. Теория и практика фосфатирования металлов. – Л. : Химия, 1973. – 407 с.
ЛАБОРАТОРНАЯ РАБОТА «МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ КОРРОЗИИ» Цель работы – определение скорости коррозии стали в кислых и нейтральных средах.
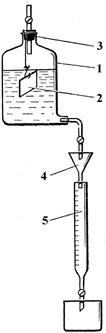
Краткие теоретические сведения Процесс разрушения металлов при химическом, электрохимическом или биохимическом взаимодействии их со средой называется коррозией. Химическая коррозия происходит в газовых средах или неэлектролитах и не сопровождается возникновением электрического тока. Этот тип коррозии подчиняется законам химической кинетики. Электрохимическая коррозия может быть атмосферной, почвенной и происходить в растворах электролитов и в расплавах солей. Она сопровождается возникновением электрического тока и подчиняется законам электрохимии. Для защиты металлов от коррозии используют покрытия, которые наносят различными способами. Гальванический способ нанесения защитной пленки заключается в выделении под действием электрического тока металлов из их растворов на покрываемой детали, которая служит катодом (никелирование, хромирование и т. д.). Химический способ заключается в образовании пленки в результате реакций, происходящих на поверхности металла под действием химических реагентов (оксидирование, фосфатирование). Лабораторная работа знакомит с практическими методами определения скорости коррозии, способами химического нанесения покрытий и определением свойств полученных пленок. Методика проведения работы Вариант I – объемный метод определения скорости коррозии В электролитах Цель работы–определение скорости коррозии металла по объему выделившегося водорода. Оборудование и реактивы: прибор для проведения опыта (рис. 2.8.1), стальные или чугунные пластинки размером 30 x 20 x 2 мм или 20 x 10 x 1 мм, раствор серной кислоты концентрации 0,1 моль/л. Ход работы. Прибор для объемного определения скорости коррозии представляет собой аспиратор с притертой пробкой, к которой при помощи стеклянных крючков крепится испытуемый образец. Водород, выделяющийся при взаимодействии металла с кислотой, вытесняет из герметически закрытого аспиратора кислоту, которая капает в бюретку через кран нижнего тубуса. Объем кислоты в бюретке будет соответствовать объему выделившегося водорода. Образцы металлов следует подготовить так. Перед проведением опыта металлическую пластинку зачищают наждачной бумагой, тщательно обезвреживают органическими растворителями, промывают водой. Для обезвреживания можно применять ацетон, бензин и другие растворители. Обезвреживание считается законченным, если при промывке водой вся поверхность образца смачивается равномерно. Образец металла поместить в аспиратор, который проверяют на герметичность. С этой целью его плотно закрывают сверху и открывают нижний кран. Вытекающие при этом небольшие количества кислоты собираются отдельно. Полного прекращения вытекания капель кислоты не следует ждать, так как в это время уже начинается выделение водорода в результате реакции. Подставляют под кран бюретку и замечают время начала опыта. Периодически через 10–20 мин отмечают объем вытекающей кислоты. Проводят опыт в течение 1–2 ч. После окончания опыта закрывают нижний кран, вынимают образец и вытесняют водород свежим раствором кислоты. Зная объем водорода, выделившегося во время опыта, определяют потери массы образца при коррозии. Объем выделившегося водорода относят к единице поверхности образца.
Рис. 2.8.1. Установка для определения скорости коррозии металла по объему выделившегося водорода: 1 – аспиратор; 2 – испытуемый образец; 3 – пробка с краном; 4 – воронка; 5 – мерная бюретка
Данные опытов и расчеты записывают в таблицу:
Вариант II – гравиметрический метод определения 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|