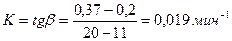|
|
ИНСТРУКЦИЯ К ЛАБОРАТОРНОЙ РАБОТЕ«Обжиг сульфидных руд в неподвижном слое» 1. Отградуировать реометр. 2. Включить печь в электросеть для нагрева. 3. Отвесить навеску серного колчедана в лодочку. 4. Когда печь нагрелась до заданной температуры, налить в поглотительные склянки заданное количество 0,1 н раствора йода. 5. Поместить в среднюю часть печи лодочку с навеской. 6. При помощи крана аспиратора быстро установить заданную скорость воздуха. 7. Через каждые 2–5 минут, не доводя до полного обесцвечивания раствор йода, производить переключение газа с работающей склянки на следующую. 8. После отключения склянки оттитровать раствор йода 0,1 н раствором тиосульфата натрия. 9. Вынуть лодочку из печи и вычистить ее. 10. Горячую лодочку брать только тигельными щипцами.
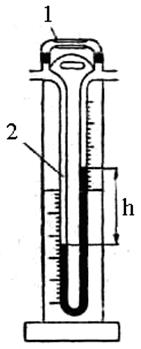
ГРАДУИРОВКА РЕОМЕТРА Реометр (рис. 2.6.2) служит для измерения скорости газового потока в лабораторных установках. Для этого газ пропускают через капиллярную трубку 1; вследствие большого сопротивления капилляра в нем происходит падение давления газа. Разность давлений до и после капиллярной трубки замеряется манометром 2 – U-образной трубкой, заполненной жидкостью (чаще всего водой) по разности уровней h в обоих коленах. Чем больше разность уровней, тем выше скорость газа. Реометр, снабженный серией различных по диаметру капилляров, которые соединяются с манометром 2 резиновыми трубками, может служить для измерения скоростей газовых потоков от 0,1 до 250 см3/мин. Добившись полной герметизации установки для обжига колчедана (см. рис. 2.6.1), градуируют реометр. Для этого, открыв краны 1 и 1· или 2 и 2· и т. п., протягивают воздух через установку при помощи аспиратора 11, осторожно открывая кран 12. Регулируя скорость истечения жидкости краном 12, устанавливают желаемую или заданную разность уровней жидкости в манометрическом колене реометра и отбирают воду, вытекающую из аспиратора за определенный промежуток времени (например, 1 минуту)в измерительный сосуд. Измеряя объем воды, вытекающей из аспиратора, рассчитывают количество воздуха, проходящее через установку в единицу времени, т. е. скорость потока воздуха. Многократным изменением разности уровней h в трубке арнометрапри помощи аспиратора получают ряд точек, соответствующих определенным скоростям воздуха. Для определения промежуточных скоростей полученные данные наносят на график, отмечая по оси х разность уровней в манометрической трубке реометра, а по оси у – объемные скорости воздуха в см3/минили в дм3/мин. При помощи такого графика приблизительно определяют все промежуточные скорости воздуха.
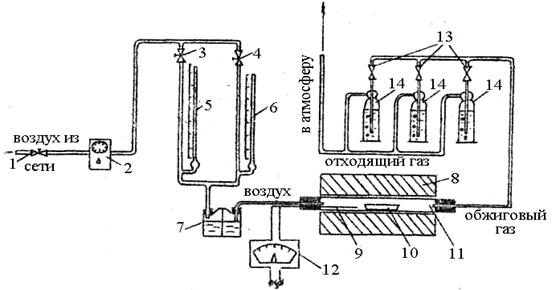
Рис. 2.6.2. Реометр: 1 – капиллярная трубка; 2 – U-образная манометрическая трубка; h – разность уровней Вариант 2 Цель работы – изучение кинетики процесса разложения колчедана в неподвижном слое на лабораторной установке, схема которой приведена на рис. 2.6.3. Схема установки и порядок выполнения работы Установка состоит из трубчатой печи 8, позволяющей вести нагрев до 850 °С, термопары 9 и терморегулирующего устройства – потенциометра – 12, Внутри печи расположена кварцевая трубка II, концы которой выступают из печи на 100–110 мм. С торцов трубка закрыта резиновыми пробками, через отверстия в которых с одной стороны поступает воздух, а с другой выходит обжиговый газ. Воздух поступает через регулировочный вентиль I, регулятор давления 2 и реометр 5, расход воздуха в котором поддерживается точным 'регулятором давления (3). Обжиговый газ на выходе из печи направляется в последовательно соединенные поглотительные склянки 14. Навеску (1 г) сульфидного материала взвешивают на аналитический весах с точностью до 0,0002 г и распределяют тонким слоем по длине лодочки 10, Предварительно фарфоровая лодочка должна быть вымыта и прокалена при температуре 850–900 °С в течение 1часа. В поглотительные склянки 14 наливают по 10 мл 0,5 н раствора йода, разбавляют его до метки дистиллированной водой и добавляют 5 капель раствора крахмала, являющегося индикатором. Раствор при этом принимает коричневую окраску. После проведения описанных выше предварительных работ и проверки установки на герметичность устанавливают на потенциометре 12 заданную преподавателем температуру, нужный расход воздуха по реометру, согласно калибровочному графику, и приступают к проведению эксперимента. По достижении заданной температуры лодочку с навеской при помощи металлического крючка помещают в центр печи, а секундомером засекают время, пошедшее на обесцвечивание раствора в поглотительной склянке. При этом необходимо помнить, что поток обжигового газа должен идти только через одну склянку до полного обесцвечивания раствора йода. После обесцвечивания раствора следует перекрыть кран 13 и обжиговый газ направить в следующую склянку. Прокаливание сульфида продолжается до тех пор, пока очередная склянка не обесцветится в течение 20–25 минут. По истечении указанного срока установку отключают и перекрывают поток воздуха. Содержимое последней склянки сливают в коническую колбу, поглотительную склянку ополаскивают дистиллированной водой и весь полученный раствор оттитровывают раствором тиосульфата натрия. ПУСК УСТАНОВКИ · проверить установку на герметичность; · установить на автоматическом потенциометре 12 заданную температуру и включить печь 8; · открыть подачу воздуха вентилем I. С помощью регулятора давления 2 и точного регулятора 3 установить на реометре 5 нужный расход воздуха; · взвесить и загрузить в предварительно прокаленную фарфоровую лодочку 10 сульфид металла и поместить её в печь 8 после установления в печи заданной температуры. ОБСЛУЖИВАНИЕ УСТАНОВКИ ВО ВРЕМЯ РАБОТЫ · контролировать и в случае необходимости регулировать расход воздуха; · контролировать заданную температуру печи; · периодически проверять герметичность установки; · определять время, пошедшее на обесцвечивание раствора йода в поглотительной склянке. При отключении установки: · закрыть вентили подачи воздуха в следующей последовательности: 3 – 2 – 1; · отключить печь; · отключить общее питание установки электроэнергией.
Рис. 2.6.3. Схема лабораторной установки для обжига сульфидов металлов: 1 – регулировочный вентиль; 2– регулятор давления; 3, 4 – точные регуляторы давления; 5 – реометр больших расходов; 6 – реометр малых расходов; 7 – склянка Тищенко; 8 – реакционная печь; 9 – термопара; 10 – лодочка с образцом; 11 – реакционная трубка; 12 – терморегулятор; 13 – запорный вентиль; 14 – поглотительные склянки
Обработка полученных данных В результате проводимых исследований студент должен установить скорость обжига колчедана в зависимости от температуры ведения процесса. В основе определения скорости обжига лежит реакция взаимодействия выделяющегося при обжиге сернистого ангидрида с раствором йода в присутствии индикатора – крахмала: SO2 +2H2O + I2 = H2SO4 + 2HI Скорость обжига колчедана определяется по количеству выделяющегося сернистого ангидрида во времени. С этой целью определяют время, пошедшее на обесцвечивание раствора йода. Наиболее удобной формой записи результатов является таблица.
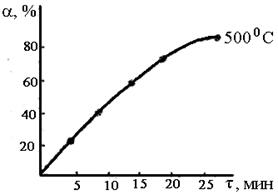
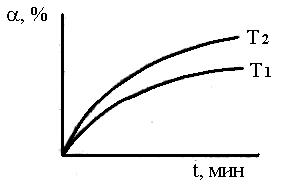
№ – номер склянки при заданной температуре; m – масса колчедана, г; w – содержание серы в колчедане, %; V(I 2 ) – объем 0,5 н раствора I2, мл; t – температура опыта, установленная в печи, ºC; a – степень выгорания серы, %; Е – энергия активации процесса, кДж/моль. Масса выделившегося сернистого ангидрида рассчитывается по формуле: m (SO2 ) = N (I2)· V( I2) 0,032. где V (I2) – объем раствора йода, взятого в первую поглотительную склянку, мл; N (I2) – эквивалентная концентрация раствора йода, моль/л; 0,032 – эквивалентное количество SO2 , соответствующее 1 мл 1н раствора йода, г. Для определения содержания SO2, поглощенного в последней склянке, оттитровывают раствором тиосульфата натрия и проводят расчет по формуле: m(SO2 ) = [(N (I2 ) × V (I2 ) – N (Na2S2O3 ) × V (Na2S2O3 ) × 0,032, где V(Na2S2O3) – объем раствора тиосульфата (0,1 н ), пошедшего на титрование, мл; С(Na2S2O3) – эквивалентная концентрация (нормальность) раствора тиосульфата натрия, моль/л. По количеству обесцвеченного раствора йода рассчитывают количество SO2, образовавшегося за определенный промежуток времени. Отнесяэто количество к теоретически возможному при полном выгорании серы (рассчитывают по содержанию серы в колчедане), получают степень выгорания серы за определенное время. По данным опытов строят график: степень выгорания серы – время;
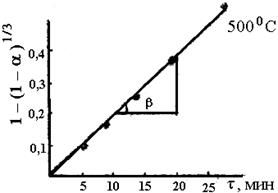
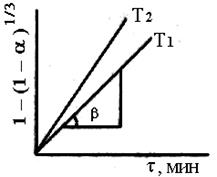
Для определения константы скорости для каждой температуры (экспериментальные данные обрабатываем в координатах уравнения сжимавшейся сферы 1 – (1 – a ) 1 / 3 = K·τ. где α– степень выгорания серы; K– константа скорости процесса (константа скорости есть тангенс угла наклона); τ – время выгорания серы. Энергия активации процесса обжига колчедана рассчитывается
Пример расчета
Масса выделившегося сернистого ангидрида в первой склянке: m1 (SO2 )= 0,5 · 10 · 0,032 = 0,16 г. Масса SO2 , поглощенного в последней склянке: m2 (SO2 )= (10 · 0,5 – 18,8 · 0,1) · 0,032 = 0,0998 г. Общее количество выделившегося сернистого ангидрида: m (SO2) = 0,16 ·4 + 0,0998 = 0,739 г. Теоретически возможно получить сернистый газ: m (0,396 × 1,1039× 64) / 32 = 0,874г Степень выгорания: α = m (sо2) пр / m (sо2)теор. Х 100 % a1 = 0,16 / 0,874 Х 100=18,3 % α2 = 36.6 %; α3 = 54,9 %, α4 = 73,2 %, α5 = 82,7 % По полученным данным строим график зависимости степень выгорания – время. Далее зависимость обрабатываем в координатах уравнения сжимающейся сферы: 1 – (1 – α) 1/3 – τ. Рассчитываем константу скорости процесса горения:
Определив константу скорости для следующей температуры, по вышеприведенной формуле рассчитываем энергию активации.
Контрольные вопросы 1. Приведите примеры сульфидного сырья для получения SO2. 2. От каких параметров зависит скорость обжига сульфидных руд? Список литературы 1. Амелин А. Г. Технология серной кислоты : учеб. пособие для втузов по спец. «Технология неорганических веществ». – 2-е изд., перераб. – М. : Химия, 1983. – 360 с. 2. Кутепов А. М. и др. Общая химическая технология. – 3-е изд., перераб. – М. : Академкнига, 2005. – 528 с..
ЛАБОРАТОРНАЯ РАБОТА «ФОСФАТИРОВАНИЕ МЕТАЛЛОВ»
Цель работы – установить зависимость защитных свойств фосфатной пленки от температуры и продолжительности процесса химического фосфатирования.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 Дж/моль
Дж/моль