|
|
Краткие теоретические сведенияРеакции в твердых фазах — это реакции, протекающие при непосредственном взаимодействии между частицами твердых веществ, а также реакции окисления, восстановления и термического разложения твердых фаз. Особенность этих реакций в том, что процесс протекает на поверхности соприкосновения взаимодействующих фаз. Вследствие локализации в пределах реакционной зоны скорость процесса пропорциональна величине реакционной зоны в каждый данный момент времени. В первый момент, как только образовались центры реакции, скорость процесса невелика, но увеличивается по мере их роста. Возникающие на начальных центрах участки реакционной зоны могут распространяться независимо друг от друга или пересекаться с образованием единого фронта реакции. Последнее соответствует максимальной скорости, после чего площадь реакционной зоны начинает сокращаться и скорость уменьшается. Процессы взаимодействия твердых веществ относятся к диффузионно-химическим процессам. Их скорость зависит от скорости реакции и от скорости диффузии и определяется скоростью наиболее медленной стадии – процесса диффузии реагирующих веществ через слой продуктов реакции. В зависимости от температуры реакция протекает по уравнениям:
CuSO4 × 5Н2O = CuSO4 × ЗН2O + 2Н2O при 50–95 °С; CuSO4 × ЗН2O = CuSO4 × Н2O + 2Н2O при 100 °С и выше; CuSO4 × Н2O = CuSO4 + H2O при 200 °С и выше. Методика проведения работы Оборудование и реактивы: сушильный шкаф, аналитические весы, тигельные щипцы, эксикатор, микрошпатель, пронумерованные бюксы, CuSO4–5H2O перекристаллизованный, растертый и высушенный на воздухе. Опыт проводится тремя студентами. Каждый студент имеет два пронумерованных бюкса. 1. Взвешивание бюксов. Возьмите два бюкса, поставьте их в сушильный шкаф при 90–92°С и выдержите в шкафу 30 минут. Выньте бюксы из шкафа, поставьте в эксикатор для охлаждения до комнатной температуры и взвесьте с точностью до 0,001 г. 2. Взвешивание бюксов с веществом. В каждый из двух бюксов поместите по 1 г CuS04 × 5H20, взвесьте на аналитических весах с точностью до 0,001 г, поставьте бюксы, полузакрытые крышками, в сушильный шкаф при 90–92°С и выдержите в течение указанного ниже времени
По окончании нагревания поставьте бюксы в эксикатор до полного охлаждения и затем взвесьте. Запишите результаты опыта по следующей форме.
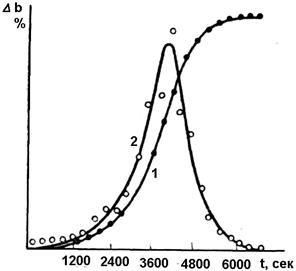
Из данных, полученных тремя студентами, постройте по шести точкам кривую зависимости уменьшения массы навески от времени. Такая кривая называется кинетической кривой, которая для реакций термического разложения имеет s-образный вид (рис. 2.4.1). Для этого отложите на оси абсцисс время в минутах в масштабе 1 мм= 1 мин, а на оси ординат процент потери массы в масштабе 1 мм = 0,1 %.
Рис. 2.4.1. Кинетика реакций термического разложения твердых фаз: 1 – зависимость потери в весе от времени; 2 – зависимость скорости реакции от времени
Проведите анализ кинетической кривой. Установите время различных периодов реакции дегидратации: начала реакции, хода реакции, окончания реакции. Укажите время, когда дегидратация практически закончилась. Постройте кривую зависимости скорости реакции дегидратации от времени. Для этого отложите на оси абсцисс время в минутах, а на оси ординат Δb /Δt, где Δb – потеря массы, а Δt – интервал времени. Для реакций термического разложения такая кривая имеет вид (рис. 2.4.1). Проведите анализ полученной из опыта кривой. Укажите время периодов изменения скорости дегидратации: роста скорости, достижения максимума, уменьшения скорости. Контрольные вопросы 1. Какие реакции называют реакциями в твердых фазах? 2. Почему дегидратация кристаллогидратов относится к реакциям в твердых фазах? 3. Что такое кинетические кривые? 4. Можно ли из кинетической кривой установить время окончания реакции? 5. Почему скорость дегидратации кристаллогидратов идет через максимум?
Список литературы 1. Соколовский А.А. Технология минеральных удобрений и кислот / А. А. Соколовский, Е. В. Яшке. – М. : Химия, 1979. – 306 с. 2. Сулименко Л. М. Технология минеральных вяжущих материалов и изделий на их основе : учебник. – 3-е изд., перераб. и доп. – М. : Высш. шк., 2000. – 304 с.
ЛАБОРАТОРНАЯ РАБОТА «ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ КОНТАКТНЫМ СПОСОБОМ»

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 (b1–b2)
(b1–b0)
(b1–b2)
(b1–b0)