
|
|
Последовательность выполнения работы1. Собрать согласно схеме или проверить предварительно собранную установку для электролиза. Кулонометр, электролизер и амперметр, соблюдая полярность, необходимо последовательно подсоединить к выпрямителю тока. 2. Подготовить поверхность катодов: алюминиевую пластинку для кулонометра и медную пластинку для исследуемого электролизера, для чего зачистить их наждачной бумагой, промыть водой и ее остатки удалить, промокнув фильтровальной бумагой. 3. Взвесить пластинки на аналитических весах. Данные записать в таблицу.
4. Подготовленные образцы зажать в клеммы для катодов (отрицательных полюсов) кулонометра и электролизера (см. рис. 6.4). Каждый катод поместить в соответствующий электролит на равном расстоянии от анодов так, чтобы уровень жидкости был на 3–5 мм выше расширенной части пластинок. 5. Поставить регулятор тока выпрямителя в крайнее левое положение и включить выпрямитель. Вращая регулятор тока вправо, установить требуемую силу тока (0,1 А). Плотность тока должна составлять 0,02–0,0З А/см2. Электролиз проводить 30 мин. 6. По истечении времени выключить ток, извлечь катоды из клемм, осторожно промыть водой и аккуратно промокнуть фильтровальной бумагой. 7. Взвесить пластинки на аналитических весах и результаты записать в таблицу, вычислив привес металла. 8. Рассчитать выход металла (Ni) по току по формуле
где Э Cu , Э Ni – эквиваленты меди и никеля, 9. Написать уравнения всех электродных процессов, происходящих на аноде и катоде в кулонометре и исследуемом электролизере. КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Поясните на конкретных примерах механизм процессов электролиза в растворах и расплавах электролитов с растворимым и нерастворимым анодами. 2. Какие процессы протекают на электродах при электролизе следующих водных растворов: H2SO4, NaCl, Cu(NO3)2, NiBr2? 3. Исходя из закона Фарадея, выведите формулу, по которой рассчитывается выход металла по току. 4. Что называется потенциалом разложения и какова природа процессов определяющих перенапряжение в системе? 5. Сколько грамм КОН образуется у катода при электролизе раствора, если на аноде выделилось 11,2 л кислорода, измеренных при нормальных условиях? 6. Какой толщины образуется покрытие железа при электролизе соли двухвалентного железа, если плотность тока составляет 10А/дм2, время электролиза 30 минут, выход по току 60%, а плотность железа 7,6 г/см3?
Работа № 16. Электрохимическое полирование металлов Цель работы – изучение процесса электролиза, основных правил разряда ионов на электродах и количественных закономерностей при протекании электродных процессов. Знакомство с практикой электрохимических измерений. Практическое применение электролиза для электрохимического полирования металлов, исследование механизма этого процесса и определение параметров оптимального режима электрополирования, обеспечивающего наилучшее качество поверхности. Теоретическое введение Электролиз с растворимым анодом широко применяется для различных технологических целей, например для очистки металлов от примесей, электрофрезерования или для обработки поверхности металлов. В последнем случае в результате анодного растворения металлов при определенных значениях плотности тока и напряжения в электролизере, а также при применении электролитов определенного состава происходит выравнивание поверхности металла анода вплоть до зеркального блеска. В результате этого процесса не только улучшается качество обработки поверхности самого металла, но и, если оно имеется, покрытия на металле, за счет удаления внешнего неравномерного слоя покрытия или дефектов на металле, возникших при его механической обработке. После электрополирования благодаря большей однородности поверхности увеличивается коррозионная стойкость металлов. При анодном растворении начиная с некоторых значений потенциалов электрода скорость растворения металла, т.е. количество ионов, переходящих в раствор в единицу времени, становится больше скорости отвода ионов. В результате в прианодном слое концентрация ионов металлов возрастает и образуется слой электролита с повышенной вязкостью, что приводит к уменьшению скорости движения ионов и к снижению общей величины тока. Однако толщина этого вязкого слоя не везде одинакова вследствие шероховатости поверхности металла, поэтому на ее выступах, где толщина слоя меньше, скорость растворения будет больше, что и приводит к выравниванию поверхности изделия. При дальнейшем повышении потенциала начинается процесс электролиза воды с интенсивным выделением на аноде кислорода, пузырьки которого срывают вязкий слой. Вследствие этого величина тока возрастает, а качество электрополирования снижается. Факт образования вязкого слоя, а следовательно и возможности полирования, можно установить по вольт-амперной характеристике электролизера – зависимости Существование вязкого слоя, обеспечивающее эффект полирования, зависит не только от режима, например, от напряжения на клеммах электролитической ванны, но и от состава электролита. Как правило, для увеличения вязкости применяют очень концентрированные кислоты. Поэтому при работе с ними необходимо проявлять крайнюю осторожность. Ниже приводятся составы электролитов, применяемых для электрополирования наиболее распространенных металлов и сплавов: ● алюминий и его сплавы: фосфорная кислота H3PO4 – 60%; серная кислота H2SO4 – 40%.; ● медь и ее сплавы: фосфорная кислота –75%, хромовый ангидрид Cr2O3 – 7,5%; ● никель и его сплавы: серная кислота – 70%; ● углеродистые и малолегированные стали: фосфорная кислота –75%, хромовый ангидрид – 5%; ● нержавеющие стали: фосфорная кислота – 43%, серная кислота –1,5%. При электрополировании в ряде случаев не удается добиться зеркальной поверхности по следующим причинам: 1) из-за образования питтингов (мест точечной коррозии) вследствие длительной задержки пузырьков кислорода на поверхности металла; 2) из-за образования непрозрачных и окрашенных плёнок, состоящих из оксидов или солей, вследствие неправильного режима электрополирования или неоптимального состава электролита; 3) из-за плохой предварительной механической обработки металла, оставляющей глубокие царапины на его поверхности; 4) из-за присутствия в электролите взвешенных частиц, которые дают направленное движение пузырькам кислорода, вследствие чего на поверхности металла образуются полосы.
Оборудование 1. Выпрямитель переменного тока ВС-24. 2. Электролизер со свинцовыми катодами и раствором электролита (70% Н2S04). 3. Миллиамперметр. 4. Милливольтметр. 5. Пластинки металла (Ni) для полирования (аноды). 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
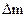
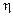 ,
%
,
%
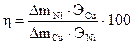 %,
%,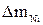 и
и 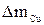 –массы меди и никеля, выделившиеся на катодах.
–массы меди и никеля, выделившиеся на катодах. . Наличие вязкого слоя, а также границы его существования определяются «провалом» на вольт-амперной кривой.
. Наличие вязкого слоя, а также границы его существования определяются «провалом» на вольт-амперной кривой.