
|
|
КРИОСКОПИЯ И ЭБУЛИОСКОПИЯФедеральное агентство по образованию __________________ МОСКОВСКИЙ АВИАЦИОННЫЙ ИНСТИТУТ (ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ) ____________________________________________________ РАСТВОРЫ. ЭЛЕКТРОХИМИЯ Учебное пособие к лабораторному практикуму по химии Утверждено на заседании редсовета 17 октября 2007 г.
М О С К В А Издательство МАИ−ПРИНТ
2 0 0 9 Авторы: Н.А. Бункина, Н.С. Буданова, В.Н. Гразлов, С. И. Селиванова, М. А. Семенова, В. А. Новожилов, А. А. Фармаковская, Н. П. Жарова, Г. Н. Устюжанинова. РАСТВОРЫ. ЭЛЕКТРОХИМИЯ Учебное пособие к лабораторному практикуму по химии/ / Под редакцией Н.С. Будановой и А.А. Фармаковской – М.: Изд-во МАИ-ПРИНТ, 2009, с: , ил.
УДК:54+541.8+541.13] (076)
Пособие содержит теоретическое введение и описание лабораторных работ по двум основным разделам курса химии: «Растворы» и «Электрохимия». В разделе «Растворы» рассмотрены вопросы равновесия в растворах неэлектролитов и электролитов, буферные растворы, коллоидные растворы, адсорбционное равновесие, ионообменная хроматография. Раздел «Электрохимия» посвящен вопросам, связанным с теорией гальванических элементов, электролиза, коррозии, а также практическим применениям электрохимических методов анализа. Пособие предназначено для студентов 1-го курса всех технических факультетов МАИ дневной и вечерней форм обучения.
Рецензенты: кафедра физики и физической химии Военно-инженерной академии им. Н.Е. Жуковского (зав. кафедрой профессор В.В. Чернышев); д-р х. н., профессор Н.Н. Желиговская. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ РАЗДЕЛ 1. РАСТВОРЫ
В окружающем нас мире практически все жидкости – это растворы. Растворы (жидкие, твердые или газообразные) представляют собой гомогенную (однородную) систему из двух или большего числа веществ (компонентов), равномерно распределенных друг в друге. При растворении одного компонента в другом или смеси других происходит изменение качественного и количественного состава растворов. Поэтому кратко раствор можно определить как многокомпонентную гомогенную систему переменного состава. Составными частями раствора являются растворитель (вещество, которое находится в избытке по сравнению с остальными веществами) и растворенные вещества. По концентрации растворенного вещества растворы принято делить на ненасыщенные, насыщенные и пересыщенные. Для характеристики количественного состава раствора при химических экспериментах чаще всего используются следующие концентрации: 1) массовые проценты — число массовых частей растворенного вещества в 100 массовых частях раствора, % ; 2) молярность М — число молей растворенного вещества в 1 л раствора [г-моль/л]; 3) нормальность N — число грамм-эквивалентов растворенного вещества в 1 л раствора [г-экв/л]; 4) моляльность 5) титр Т — число граммов растворенного вещества в 1 см3 (мл) раствора [г/см3]; 6) мольная доля— отношение числа молей растворенного вещества к сумме числа молей всех компонентов раствора
Глава 1. РАВНОВЕСИЯ В РАСТВОРАХ НЕЭЛЕКТРОЛИТОВ. КРИОСКОПИЯ И ЭБУЛИОСКОПИЯ Экспериментальным путем (Рауль, 1887 г.) установлено, что давление пара растворителя над раствором ниже, чем над чистым растворителем и «относительное понижение давления насыщенного пара над раствором Δрравно мольной доле растворенного нелетучего вещества» (закон Рауля): где Закон Рауля справедлив для идеальных или бесконечно разбавленных растворов неэлектролитов (веществ, не распадающихся на ионы под действием полярных молекул растворителя). Из этого закона следует, что температура кипения разбавленного раствора, содержащего нелетучее растворенное вещество, выше, а температура замерзания соответственно ниже температуры кипения и замерзания чистого растворителя. Это следствие можно сформулировать так: «Повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества»:
где
Измерение как разности температур замерзания
Моляльность Моляльность раствора раствора
отсюда
Для электролитов в закон Рауля вводится поправка — изотонический коэффициент i, который показывает, во сколько раз возрастает число частиц в растворе вследствие диссоциации электролита:
Поэтому для растворов электролитов:
Изотонический коэффициент связан со степенью диссоциации α, которая представляет собой отношение числа продиссоциировавших молекул N к первоначальному числу N0:
Очевидно, что число продиссоциировавших молекул N будет равно N0α, а величина [N0 - N0α = N0 (I — α)] определит число непродиссоциировавших молекул. Общее же число частиц в растворе будет равно [ Изотонический коэффициент, таким образом, представляет собой отношение
По этому уравнению можно рассчитать степень диссоциации электролита, зная изотонический коэффициент, который в свою очередь определяется экспериментально как отношение полученного опытным путем значения свойства раствора, например
следовательно:

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 — число молей растворенного вещества в 1000 г растворителя [г-моль/кг растворителя];
— число молей растворенного вещества в 1000 г растворителя [г-моль/кг растворителя];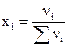 .
. ,(1.1)
,(1.1) — давление насыщенного пара чистого растворителя;
— давление насыщенного пара чистого растворителя; 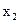 — мольная доля растворенного нелетучего вещества.
— мольная доля растворенного нелетучего вещества. ;
; 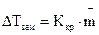 ,
, – повышение температуры кипения раствора;
– повышение температуры кипения раствора;  – понижение температуры замерзания раствора;
– понижение температуры замерзания раствора;  — моляльность раствора;
— моляльность раствора;  – криоскопическая постоянная;
– криоскопическая постоянная;  –
–  эбуллиоскопическая постоянная.
эбуллиоскопическая постоянная. = 1,86о,
= 1,86о,  = 0,52о для бензола
= 0,52о для бензола 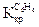 = 4,90о,
= 4,90о,  = 2,65о.
= 2,65о. (эбулиоскопия) раствора и чистого растворителя дает способ экспериментального определения молярной массы неэлектролита. Для этого навеску в граммаx
(эбулиоскопия) раствора и чистого растворителя дает способ экспериментального определения молярной массы неэлектролита. Для этого навеску в граммаx  вещества с неизвестной молярной массой М2, содержащей
вещества с неизвестной молярной массой М2, содержащей 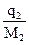 молей растворенного вещества, растворяют в известном количестве растворителя
молей растворенного вещества, растворяют в известном количестве растворителя  и измеряют повышение температуры кипения или понижение температуры замерзания:
и измеряют повышение температуры кипения или понижение температуры замерзания:
 , (1.3)
, (1.3) 

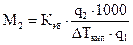 , или
, или  . (1.4)
. (1.4) . (1.5)
. (1.5)
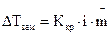 .(1.6)
.(1.6) . (1.7)
. (1.7) ], где n – суммарное число ионов, на которое распадается одна молекула электролита.
], где n – суммарное число ионов, на которое распадается одна молекула электролита.
 . (1.7 а)
. (1.7 а) к теоретическому (расчетному) значению:
к теоретическому (расчетному) значению: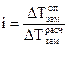 , (1.7 б)
, (1.7 б) . (1.8)
. (1.8)