|
|
А. Теоретическое введениеЭлемент Якоби-Даниэля Cu│CuSO4║ZnSO4│Zn может работать в режиме разряда и заряда, т.е. выполнять роль вторичного источника тока – аккумулятора. Электрохимическая реакция, протекающая в элементе, записывается следующим образом: Zn + CuSO4 ↔ ZnSO4 + Cu. При разряде происходит прямая реакция, химическая энергия которой превращается в электрическую. При заряде подведенная электрическая энергия вызывает обратный процесс. Основной характеристикой любого источника тока является его электродвижущая сила (ЭДС), которая равна разности потенциалов катода и анода на бестоковом режиме. Для медно-цинкового элемента Якоби−Даниэля стандартная ЭДС при 298 К равна 1,1 В
Величина ЭДС зависит от концентрации (активности) ионов в растворах, в которые погружены медный и цинковый электроды, и вычисляется по формуле Нернста:
где На практике более важным параметром, чем ЭДС, является напряжение химического источника тока при замкнутой внешней цепи – напряжение разряда. Оно всегда меньше, чем ЭДС разомкнутой цепи. Это связано с тем, что при прохождении по цепи тока вследствии явления поляризации потенциал анода сдвигается в положительную сторону, а потенциал катода – в отрицательную. Смещение потенциала электрода называется также перенапряжением: Епол= Ei – Eо, где Епол – потенциал поляризации (перенапряжение), Ei – потенциал электрода под током. Eо – потенциал электрода на бестоковом режиме. Поляризация электродов может быть вызвана различными причинами. Важнейшие из них – замедленный разряд ионов, пассивация металлов, изменение концентрации ионов у поверхности электродов и др. Кроме того, часть ЭДС теряется на преодоление внутреннего сопротивления элемента (Еомич). Таким образом, напряжение элемента при разряде Еразр = ∆Е - Епол - Еомич. Разрядное напряжение уменьшается со временем и с увеличением плотности тока. При заряде элемента анод и катод меняются местами и рассмотренные факторы приводят к росту зарядного напряжения по сравнению с ЭДС: Езар = ∆Е + Епол + Еомич. Зарядное напряжение возрастает во времени и с увеличением плотности тока. Кривая зависимости напряжения элемента от плотности тока получила название вольт-амперной характеристикой (ВАХ) или поляризационной кривой. Б. Экспериментальная часть Оборудование и реактивы 1. Медная и цинковая пластины. 2. Химические стаканы. 3. Электролитический ключ − U-образная стеклянная трубка, заполненная КСl и агар-агаром для увеличения вязкости раствора. 4. Переменный резистор, выполняющий роль нагрузки (R). 5. Амперметр (A). 6. Цифровой вольтметр(U). 7. Выпрямитель КЭФ-8. 8. Растворы солей: 1 М раствор ZnSO4 и 1 М раствор CuSO4. Последовательность выполнения работы А. Измерение ЭДС гальванического элемента. 1. Собрать модель элемента Якоби-Даниэля, для чего: ● в один из стаканчиков на одну треть налить 1 М раствор ZnSO4, а в другой – 1 М раствор CuSO4, замкнуть внутреннюю цепь, соединив электролиты электролитическим ключом; ● медную и цинковую пластины зачистить наждачной бумагой, промыть водой и осушить фильтровальной бумагой; ● опустить пластины в растворы соответствующих солей. 2. Подключить электроды к цифровому вольтметру: медный к клемме «1–10», цинковый – к клемме «0» (сзади прибора). 3. Род работы прибора поставить на «U», предел измерений «1–10». 4. Включить цифровой вольтметр в сеть и измерить напряжение элемента. Б. Работа гальванического элемента в режиме разряда
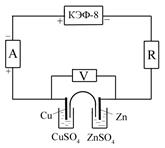
1.Собрать электрическую цепь по схеме 1 (рис. 6.3.), при этом тумблер амперметра установить на «1,5 А». 2. После замыкания цепи сразу начать снимать вольт-амперную характеристику, для чего постепенно увеличивая ток (на 4–6 делений) путем уменьшения сопротивления (ручку резистора вращать вправо) измерять напряжение элемента. Измерения вести во всем диапазоне величин сопротивления (до упора ручки резистора). 3. Данные занести в таблицу.
Схема 1 Схема 2 Рис. 6.3. Измерительные схемы 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 B.
B.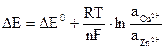 ,
, и
и  − активности соответствующих ионов.
− активности соответствующих ионов.