|
|
Работа № 1. Определение эквивалента металла газометрическим методомА. Теоретическое введение Эквивалентом элемента называют такую его массу, которая без остатка взаимодействует с одной массовой частью (м.ч.) атомов водорода или с восемью м.ч. атомов кислорода или же замещает указанное количество водорода и кислорода в химических реакциях. Из определения следует, что эквивалент водорода равен 1 м.ч. (или 1 г, в этом случае его называют грамм-эквивалентом), а эквивалент кислорода─ 8 м.ч. (8 г). Эквиваленты можно выразить через объемные единицы. В этом случае необходимо применить закон Авогадро: «В равных объемах различных газов или паров при одинаковых внешних условиях (температура и давление) содержится одинаковое количество молекул» и его следствия. Например, 1 моль любого газа при нормальных условиях (н.у.) содержит 6,02∙1023 молекул – число Авогадро (NА) и, как следствие, один моль любого газа (при н.у.) занимает объем 22,4 л. В связи с тем, что водород и кислород – газы, то в расчетах эквивалентов элементов можно сравнивать их количества не с массами эквивалентов этих газов, а с объемами их эквивалентов. Так как масса г-эквивалента водорода равна 1/2 массы моля водорода, а масса г-эквивалента кислорода равна 1/4 массы моля кислорода, следовательно, согласно закону Авогадро:
Эквиваленты элементов (Fe, Zn, Ca, Cu и др.) рассчитываются по формуле Э = А/В, где «А» ─ атомная масса элемента, «В» ─ степень его окисления, т.е. его валентность. Например, г-эквивалент меди в оксиде меди CuO или в соли CuSO4 равен Э(Cu)= Эквиваленты «сложных» веществ (оксидов, оснований, кислот, солей) рассчитываются следующим образом. Эквивалент кислоты равен отношению молекулярной массы кислоты (М) к ее основности (т.е. числу атомов водорода, участвующих в данной реакции). Например, г-эквивалент серной кислоты (в том случае, если в реакции участвуют два атома водорода) рассчитывается по формуле
Эквивалент основания равен отношению молекулярной массы щелочи (М) к ее кислотности (т.е. числу групп ОН-, участвующих в данной реакции). Например, г-эквивалент гидроксида натрия рассчитывается по формуле
Эквивалент соли равен отношению молекулярной массы соли (М) к произведению числа атомов металла, входящих в состав соли, на его валентность. Например, г-эквивалент сульфата алюминия Al2(SO4)3 рассчитывается по формуле:
Эквиваленты можно определить, используя один из основных стехиометрических законов химии – закон эквивалентов, которому подчиняются все реагирующие между собой вещества. Как простые, так и сложные: «Все вещества реагируют друг с другом в эквивалентном количестве, то есть количества эквивалентов каждого из участников реакции равны между собой». Для реакции, протекающей согласно уравнению a ∙A + b ∙B = d ∙D + f ∙F, закон эквивалентов запишется следующим образом:
Так как количество эквивалентов вещества n, содержащихся в определенной его массе, равно откуда следует, что массы реагирующих веществ пропорциональны их эквивалентам:
Для веществ, реагирующих в растворах, закон эквивалентов можно выразить формулой
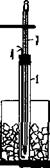
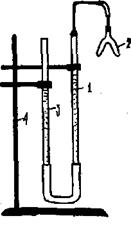
где NA и NB – нормальные концентрации растворов веществ А и В, выраженные в г-экв/л; а VA и VB – объемы растворов, л Б. Экспериментальная часть Цель работы ─ изучение практической значимости закона эквивалентов для стехиометрических расчетов и определение с помощью газометрического метода эквивалента и атомной массы металла с известной валентностью. Оборудование Прибор для проведения эксперимента (рис. 6.1), включающий: ● «рабочую» (1) и «вспомогательную» (3) бюретки, заполненные водой и соединенные резиновым шлангом (сообщающиеся сосуды); ● двухколенную (2) пробирку, герметически присоединяемую к прибору во время эксперимента к «рабочей» бюретке; ● штатив (4) для крепления установки.
Рис. 6.1. Прибор для определения эквивалента металла газометрическим методом Последовательность выполнения Работы
1. Заполнить таблицу
*Навеска исследуемого металла, масса которой определяется с точностью до 0,0001 г, выдается студентам лаборантом. ** Данные, соответствующие строкам 5-7, предоставляются преподавателем.
2. Перед началом проведения эксперимента, необходимо отсоединить двухколенную пробиркуот основной бюретки, вылить содержимое пробирки (если оно имеется) в раковину и тщательно промыть двухколенную пробирку водопроводной водой. 3. Расположить рабочую и вспомогательную бюретки путем маневрирования их положения по высоте таким образом, чтобы уровень воды в основной бюретке был около нулевого значения. 4.Навеску металла поместить в одно из «колен» двухколенной пробирки. 5. В другое «колено» пробирки прилить (аккуратно, чтобы исключить попадание кислоты в «колено» с навеской металла) ~ 2 мл раствора соляной кислоты, т.е. до метки, нанесенной красным химическим карандашом. 6. Двухколенную пробирку вращательным движением плотно надеть на пробку (мениск воды в основной бюретке при этом немного сместится от нулевого значения). 7. Проверить герметичность прибора. С этой целью вспомогательную бюретку, предварительно освободив от крепления, резко опустить вниз на 15–20 см. Если прибор герметичен, то мениск воды в ней останется практически на том же уровне. Если герметичность отсутствует, мениски воды в бюретках будут постепенно сравниваться. В этом случае с помощью лаборанта следует проверить надежность соединений в приборе. 8. Перед началом эксперимента необходимо установить давление в герметичном приборе равным атмосферному давлению. Для этого, перемещая бюретки относительно друг друга, следует добиться, чтобы мениски воды в бюретках находились строго на одной высоте, т.е. на одной горизонтальной прямой. 9. Записать в таблицу значение начального уровня воды в рабочей бюретке. 10. Бережно прилить кислоту в «колено», где находится навеска металла, наклоняя пробирку осторожно, чтобы не нарушить герметичность прибора. Для того чтобы исключить разгерметизацию прибора в ходе выделения водорода по реакции, вспомогательную бюретку следует аккуратно снижать по высоте, а рабочую поднимать, добиваясь тем самым соблюдения положения менисков воды на одном уровне. 11. Полное растворение металла по реакции фиксируется визуально: выделение пузырьков водорода и понижение уровня воды в рабочей бюретке прекращается. Удостоверившись, что раствор в пробирке охладился до комнатной температуры, записать в таблицу конечный уровень воды после окончания эксперимента. 12. Перевести объем выделившегося водорода, измеренный при данном атмосферном давлении V(H2), к объему при нормальных условиях V0, используя уравнение, объединяющее газовые законы Бойля–Мариотта и Гей–Люссака:
где р0 – нормальное атмосферное давление (760 мм рт.ст.); V0 – объем водорода при нормальных условиях; То – нормальная температура по абсолютной шкале (273 К); р1 – давление водорода в условиях опыта (рн2 ,мм рт.ст.), V1 – объем водорода в условиях опыта (V (Н2), мл; Т – температура опыта (273 + t°С). 13. Рассчитать эквивалент металла по закону эквивалентов, используя пропорцию:
Э(Ме), г – 11 200 мл (Н2) 14. Рассчитать атомную массу металла по формуле А (Ме) = Э (Ме) ∙ В(Ме). 15. Используя периодическую таблицу элементов Д.И. Менделеева, определить природу металла по опытному значению атомной массы (группа элементов в таблице совпадает со степенью окисления металла, т.е. с его валентностью 2. 16. Составить уравнение реакции найденного металла с соляной кислотой. 17. Вычислить относительную ошибку опыта:
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ 1. Что называется химическим эквивалентом? 2. Сформулируйте закон эквивалентов. 3. Сформулируйте закон парциальных давлений, установленный Дальтоном. 4. Как вычисляется эквивалент сложного вещества (оксидов, кислот, оснований и солей)? 5. Вычислите эквивалент хрома в оксиде, в котором содержится 52% хрома и 48% кислорода. 6. Окислением 2,8 г кадмия получено 3,2 г оксида. Вычислите эквивалент кадмия. Работа № 2. Криометрия Цель работы – определение температуры кристаллизации (замерзания) раствора и использование этого физико-химического свойства для расчета молекулярной массы растворенного неэлектролита и степени диссоциации раствора электролита. Оборудование и реактивы 1. Прибор криометр (рис. 6.2), состоящий из: а) широкой стеклянной пробирки (1) для исследуемого раствора, закрепленной в штативе (2); б) пробки со вставленным в нее термометром (3) и металлической мешалкой (4); в) сосуда (криостата) (5) для охладительной смеси, которая готовится изо льда и 1-2 столовых ложек поваренной соли. 2. Мерный цилиндр. 3. Растворы неэлектролита и электролита.
Рис. 6.2. Прибор для криометрических измерений

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 = 11,2 л
= 11,2 л = 5,6 л.
= 5,6 л. г.
г.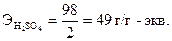
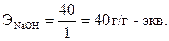
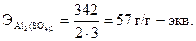
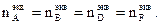
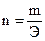 , то закон эквивалентов можно записать иначе:
, то закон эквивалентов можно записать иначе: 
 ,
,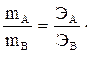
 ,
,
 ,
, – Vo (Н2), мл
– Vo (Н2), мл [%].
[%].