|
|
Синтез гексафторбутадиена
Гексафторбутадиен () CF2=CF—CF=CF2 получают по перфторбутадиен схеме: Cl2Br2 CHF2CF2CF=CF2 CHF2CF2CFClCF2Cl Zn → СBrF2CF2CFClCF2Cl → CF2=CF—CF=CF2. Выход мономера составляет 72%. Синтез перфторалленов
Перфтораллены получают из диперфторметилацетилена и перфторалки-лиодидов в две стадии. На первой стадии происходит гомолитическое присоединение перфто-ралкилиодида по тройной связи (513 К): CF3 I CF3 CF3 CF3CºCCF3 + RFI C=C + C=C RF CF3 RF I На второй стадии перфториодэтилены подвергают пиролизу над свежеосаж-денным порошком меди: Cu RF(CF3)C=C(l)CF3 → RF(CF3)C=C=CF2. 473 К
Получение других фторпроизводных углеводородов
Синтез трифторхлорэтилена
Трифторхлорэтилен (перфторвинилхлорид) CCIF=CF2-газ с т. кип. 246,2 К, т. пл. 115,8 К, n2020 0,934. Его получают жидкофазным дехлориро- D 1,3960, d4 ванием CCl2FCClF2 в среде метилового спирта при 323-423 К, 2 МПа, времени контакта 3-4 с в присутствии в качестве катализатора цинка: Zn CCl2F—CClF2 - CClF=CF2. ZnCl2 Газофазное дехлорирование проводят в среде водорода при 763-823 К и давлении 0,1 МПа в реакторе с медной сеткой.
Cинтез симм-дихлордифторэтилена симм-Дихлордифторэтилен с выходом 90-95% получают дегалогенирова-нием тетрахлордифторэтана цинком в среде этилового спирта: Zn CFCl2—CFCl2 CFCl=CFCl. C2H5OH
Синтез 3,3,3-трифторпропилена
20 0,996 при 3,3,3-Трифторпропилен CF3CH=CH2 - газ с т. кип. 498 К и d4 298 К. 3,3,3-Трифторпропилен получают в основном из акриловой кислоты: HX (X=Cl, Br) SF4 СН2=CHCOOH XCH2CH2COOH Спирт. р-р KOH XCH2CH2CF3 - CH2=CH-CF3. -HX
Представляет интерес также синтез этого соединения при совместном электролизе пропионовой и трифторуксусной кислот: CF3COOH ·CF3, C2H5COOH CH2=CH2, -CO2,-Н2О
· CH2=CH2 + · CF3 CF3CH2—CH2, · R CF3CH2CH2 CF3CH=CH2. -RH Получение хладонов (фреонов) Хладоны (фреоны) - хлорфторпроизводные алифатических углеводородов - широко используют в качестве хладоагентов холодильных установок. Фреоны обладают большими преимуществами по сравнению с другими хладагентами, например аммиаком. Они отличаются низкой токсичностью, не воспламеняют-ся и не образуют взрывчатых смесей с воздухом, не оказывают коррозионного воздействия на металлы. Важной областью применения фреонов является аэро-зольное распыление веществ. Некоторые фреоны являются промежуточными продуктами в производстве фторолефинов. Для фреонов введены сокращенные обозначения соответствующие их химической формуле. Первая цифра справа обозначает число атомов фтора в молекуле фреона; вторая цифра (средняя) - на единицу больше числа атомов водорода; третья цифра - на единицу меньше числа атомов углерода. В цифро-вом обозначении фреонов - хлорфторпроизводных метана - третьей цифрой яв-ляется ноль, который опускается. В табл. 5.2 приведены физические свойства наиболее важных фреонов. Таблица 5.2. Физические свойства фреонов Условное Формула Т. затв., К Т.кип., К Т.кр., К Ркр, обозначение МПа Ф-11CCl3F 162 296,8 471 4,32 Ф-12 CCl2F2 115 243,2 385 4,01 Ф-13 CClF3 92 191,5 301,8 3,81 Ф-14 CF4 89 145,1 - - Ф-21 CHCl2F 138 281,9 451,5 5,10 Ф-22 CHClF2 113 232,2 369 4,87 Ф-23 CHF3 110 198,8 - - Ф-112 CCl2F-CCl2F 299 365,8 551 3,40 Ф-113 CClF2-CCl2F 238 320,6 487 3,37 Ф-114 CClF2-CClF2 179 276,6 418,7 3,21 Ф-124а CClF2-CHF2 156 262,8 399,7 3,67 Ф-142 C2H3ClF2 142,2 263,2 - - Ф-143 C2H3F3 261,7 225,4 - -
Основным методом синтеза хлорфторуглеводородов является гидрофто-рирование соответствующих хлорпроизводных. При гидрофторировании тетра-хлорметана получают преимущественно дифтордихлорметан: HF nCCl4 CCl3F + CCl2F2 + CClF3 3% 90% 0,5% Процесс проводят в жидкой фазе в присутствии SbF3 и SbF5 при 383 К и 3 МПа. Наряду с жидкофазным фторированием в промышленности осуществля-ют и газофазный процесс при 523-723 К, атмосферном давлении в присутствии катализатора FeCl3 на активированном угле. Дифтордихлорметан и дифтор-хлорметан получают с высокими выходом и селективностью. Промышленный метод получения дифторхлорметана (Ф-12) и фтортри-хлорметана (Ф-11) заключается в хлорировании метана на катализаторе AlF3: Cl2, HF nCH4 CCl2F2 + CCl3F + HCl.
Трифтортрихлорэтан (Ф-113) получают действием на перхлорэтилен сме-си Cl2 и HF при 573-773 К в присутствии AlF3, CrF3 или гидрофторированием гексахлорэтана в присутствии SbF3. Из фторхлоралкенов наибольшее значение имеет трифторхлорэтилен, по-лучаемый дегидрохлорированием трифтортрихлорэтана в газовой фазе:
CClF2СCl2F + H2 CClF=CF2 + 2HCl.
Трифтортрихлорэтан обрабатывают водородом при мольном соотношении фреон : водород, равном 5:1, 763-823 К и 0,1 МПа на медной сетке. В качестве катализаторов могут быть использованы также кобальт, серебро, платина. В ка-честве побочных продуктов образуются винилиденфторид и трифторэтилен, которые очень плохо отделяются от трифторхлорэтилена. Жидкофазный процесс дехлорирования фреона-113 осуществляют в при-сутствии порошка цинка в виде суспензии в метаноле или этаноле при 323-423 К и 0,2 МПа при времени пребывания реагентов в зоне реакции в течении не-скольких секунд. Галогенфторолефины находят широкое применение в синтезе различных фторированных соединений путем замещения галогена. Например, из доступ-ного a-хлорперфторизобутилена кипячением с иодидом натрия в ацетоне полу-чают a-иодперфторизобутилен, а на его основе перфторизобутенилмагнийбро-мид, который используют в синтезе ряда производных перфторизобутилена.
Глава 6
ВИНИЛОВЫЕ МОНОМЕРЫ С АРОМАТИЧЕСКИМИ И ГЕТЕРОЦИКЛИЧЕСКИМИ ЗАМЕСТИТЕЛЯМИ
К виниловым мономерам с ароматическими и так называемыми сложными заместителями относятся стирол, a-метилстирол, винилтолуол, винилкетоны, винилпиридины, винилкарбазолы и др.
СТИРОЛ И ЕГО ПРОИЗВОДНЫЕ
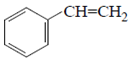
Стирол (винилбензол, фенилэтилен)
является исходным мономером для производства полистирола. Впервые стирол был выделен в 1831г. Однако до Второй мировой войны стирол и его полимеры широко не применялись в промышленности. В промышленном масштабе стирол был получен впервые в Германии в 1930г. Производство стирола началось в США в 1933г., но ситезированный из него полистирол был низкого качества и высокой стоимости. Стирол использовали только для производства полистирола в виде порошка для литья под давлением. Наличие же больших производственных мощностей по производству мономерного стирола стимулировало расширение исследований по применению полистирола в новых областях, в частности, в производстве товаров массового потребления. Развитие исследований в области синтеза полимеров и сополимеров стирола привело к созданию большой группы полимерных материалов с самыми разнообразными свойствами. Из мономеров для производства каучука общего назначения стирол как сомономер по объему производства находится на третьем месте, уступая изопрену и бутадиену. До начала 1960-х годов, когда появились стереорегулярные бутадиеновые и изопреновые каучуки, бутадиенстирольные каучуки были наиболее массовыми среди всех выпускаемых эластомеров. В промышленном масштабе выпускаются различные многокомпонентные сополимеры стирола. Наиболее крупнотоннажные из них – акрилонитрил-бутадиен-стирольные (АБС-сополимеры), вырабатываемые в широком ассортименте в зависимости от соотношения исходных мономеров и условий проведения процесса. На их основе получены самые разнообразные ударопрочные конструкционные материалы, с усиливающими наполнителями или в сочетании с другими полимерами. Пластмассы на основе АБС-сополимеров получили широкое распространение в различных областях промышленности благодаря высокой химической стойкости, ударопрочности, теплостойкости и другим свойствам. Эти пластмассы легко перерабатываются литьем, экструзией, прессованием. Разработаны также сополимеры винилхлорид-бутадиен-стирол, акрилат-стирол-диеновый каучук, сополимер стирол-акрилонитрил-метилмета-крилат, сополимер акрилонитрил-стирол-эфир или амид a-цианокоричной кислоты и другие.
Получение стирола

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|