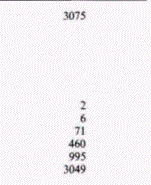|
|
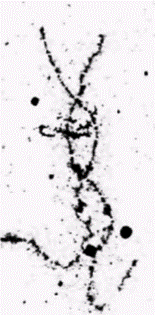
Хромосомные пуфы и хромосомы типа ламповых щетокПрирода политенных хромосом и их пуфов была рассмотрена в гл. 10. Представленные в ней данные иллюстрируют контроль за активностью определенных генов на уровне транскрипции. Если к слюнным железам добавляют экдистерон, то наблюдается возникновение одних пуфов и исчезновение других. Образование пуфов опосредовано присоединением экдистерона к специфическим участкам на хромосомах. Это может быть продемонстрировано путем «сшивания» экдистерона с хроматином, которое фиксирует его положение на местах связывания. Затем добавляют кроличьи антитела против экдистерона и несвязавшиеся антитела удаляют промывкой. В конце добавляют меченные флуоресцеином козьи антитела, полученные против иммуноглобулинов кролика, и несвязывавшиеся антитела отмывают. В результате флуоресцентная метка должна обнаруживаться в тех местах, где козьи антитела связались кроличьими антителами, а кроличьи антитела должны присоединяться только к экдистерону. Таким образом, флуоресцентная метка должна появиться на хромосоме в каждом сайте, где был связан экдистерон (Gronemeyer, Pongs, 1980). Результаты свидетельствуют о том (рис. 11.16), что практически все экдистерон-чувствительные пуфы связывают экдистерон. Экдистерон-чувствительные пуфы, обнаруживаемые у поздней личинки третьего возраста (когда она готовится стать куколкой), можно грубо разделить на три категории. Пуфы, которые исчезают в присутствии экдистерона; пуфы, которые быстро индуцируются экдистероном, и пуфы, которые появляются через несколько часов после стимуляции экдистероном. Ранние пуфы формируются в пределах 1 ч после добавления экдистерона. Кроме
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 122____________ ГЛАВА 11_______________________________________________________
того, они, по-видимому, синтезируют продукты, которые необходимы для индукции поздних пуфов. Если к культивируемым клеткам дрозофилы добавить ингибиторы синтеза белка вскоре после того, как образовались ранние пуфы, то экдистерон не будет стимулировать формирование поздних пуфов. Очевидно, таким образом, что для образования поздних пуфов требуются и экдистерон, и продукты ранних пуфов (Ashburner, 1974). Важно отметить, что экдистерон не только стимулирует образованиепуфов в определенных участках хромосом личинки, но вызывает также регрессиюнекоторых уже существующих пуфов. Один из таких пуфов находится в положении 68С на левом плечехромосомы III.Этот сайт содержит ген для Sgs 3, «белка клея», обеспечивающего прикрепление оболочки куколки к твердой поверхности (Korge, 1975). У личинок последнего возраста этот участок хромосомы образует пуф только в слюнных железах. Добавление экдистерона к культивируемым слюнным железам вызывает быструю регрессию этого пуфа и прекращение транскрипции с данного гена (Crowley, Meyerowitz, 1984). Таким образом. белок клея может синтезироваться, когда он нужен для прикрепления личинки к субстрату, но после этого ген выключается и происходит метаморфоз. Как будет рассмотрено более подробно в следующей главе, транскрипционная активность связана с изменениями в хроматине, и эти изменения могут быть вызваны присоединением негистоновых белков хроматина. Переваривание хроматина дрозофилы ДНКазой I приводит к высвобождению белка с молекулярной массой 63000, который связывается со всеми экдизон-чувствительными локусами личинки третьего возраста (рис. 11.17). Хотя этот белок по своим размерам больше, чем белки, предположительно отвечающие за активацию транскрипции генов у позвоночных, он может выполнять аналогичную функцию в установлении и поддержании структуры хроматина, необходимой для активности генов (Mayfield et al., 1978). Пуфы представляют собой расплетенную ДНК в определенных областях хромосом личинок насекомых. Так как эти хромосомы политенные, характерный вид пуфа создается тысячами нитей. Аналогичное расплетание ДНК в случае неполитенных хромосом наблюдается в ооцитах амфибий. Соответствующие структуры называют хромосомами типа ламповых щеток. На стадии диплотены мейоза компактные хромосомы амфибий образуют большие петли ДНК и втягивают их обратно после завершения этой стадии (рис. 11.18). Представление о том, что подобное расплетание хромосом позволяет экспрессироваться определенным генам, может быть подтверждено с помощью гибридизации in situ. Для этого следует приготовить препараты хромосом ооцитов, денатурировать их и проинкубировать с радиоактивной РНК, которая кодирует определенный белок. После того как несвязавшаяся РНК удалена отмывкой, радиоавтография позволяет точно определить местоположение гена. На рис. 11.19 показана хромосома I на стадии диплотены из ооцита тритона Triturus cristatus после инкубации с радиоактивной мРНК для
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 123
гистонов Очевидно, что ген гистона (или набор гистоновых генов) локализован на одной из петель хромосомы типа ламповой щетки (Old et al., 1977). На электронной микрофотографии транскрипты генов на хромосомах типа ламповых щеток очень напоминают транскрипты на амплифицированных генах рибосомной РНК. Та же полярность «рождественской елки», но обычно (за исключением семейств, подобных гистоновым генам) на каждой петле имеется только одна транскрипционная единица (Hill, MacGregor, 1980). Синтез овальбумина Огромное яйцо курицы защищено многими дополнительными слоями, которые секретируются на его поверхность при прохождении яйца через яйцевод (рис. 11.20). Овулировавшее яйцо попадает в воронку левого яйцевода (правый яйцевод атрофируется у большинства птиц), где вскоре и происходит оплодотворение. Затем яйцо проходит в магнум, где секретируется овальбумин и другие полипептиды яичного белка, в перешеек, где оно одевается несколькими оболочками, и наконец, в матку, где добавляются вода, соли и скорлупа из углекислого кальция. Основным продуктом клеток стенки магнума является овальбумин, и у кур-несушек овальбумин составляет более 50% белков клеток стенки. Продукция овальбумина зависит от присутствия полового гормона эстрогена. Эстроген проникает в клетку и захватывается белком-рецептором, который доставляет его в ядро. Комплекс эстроген рецептор проходит через ядерную мембрану и связывается с хроматином, где стимулирует транскрипцию. Зависимость синтеза овальбумина от присутствия эстрогена наглядно показана в опыте, когда эстроген был инъецирован молодым курам (Palmi-
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. 124_______________ ГЛАВА 11______________________________________________________________________________
ter, Schimke, 1973). Эти инъекции вызывают дифференцировку пристеночных желез магнума и индуцируют синтез основных полипептидов яичного белка: овальбумина, кональбумина, овомукоида и лизоцима. За 2 нед обработки эстрогеном уровень овальбумина поднимается с исчезающе малых количеств до более чем 50% всех новосинтезированных клеточных белков (рис. 11.21). Удаление эстрогена вызывает снижение синтеза овальбумина, несмотря на то что клетки сохраняют свое дифференцированное состояние. Через две недели после удаления эстрогена зарегистрировать наличие овальбумина не удавалось. Этот опыт показывает только то, что синтез овальбумина зависит от присутствия гормона. Он не говорит нам о том, какова рабочая концентрация этого гормона. Можно представить, что гормон или усиливает транскрипцию, или стабилизирует полипептид овальбумина или его мРНК, или даже способствует транспорту овальбуминовой мРНК через
Гилберт С. Биология развития: В 3-х т. Т. 2: Пер. с англ. – М.: Мир, 1994. – 235 с. __________________ ИЗМЕНЕНИЕ ТРАНСКРИПЦИИ В ХОДЕ РАЗВИТИЯ_______________________________________ 125
ядерную мембрану. На следующем этапе следовало найти корреляцию между уровнем эстрогена и присутствием овальбуминовой мРНК (Harris et al., 1975; McKnight, Palmiter, 1979). Чтобы осуществить это, на изолированной овальбуминовой мРНК была получена комплементарная ДНК. Овальбуминовую мРНК получали, пропуская цитоплазматическую мРНК из клеток яйцевода через колонку, содержавшую гранулы олиго(дТ)-целлюлозы (рис. 11.22). Эти гранулы связывают мРНК, поскольку цепи из дезокситимидина на гранулах присоединяют поли(А)-хвосты молекул мРНК. Все другие нуклеиновые кислоты проходят через колонку свободно. Связавшуюся мРНК затем удаляли с колонки и разделяли на фракции с помощью электрофореза. Овальбуминовую мРНК можно легко выделить (так как она преобладает среди мРНК клетки) и затем транслировать in vitro для подтверждения того, что она кодирует овальбумин. Далее овальбуминовую мРНК использовали как матрицу для обратной транскриптазы и получали кДНК-зонд. Этот зонд позволяет «выловить» любую комплементарную последовательность и может зарегистрировать единичную копию гена овальбумина. Данные табл. 11.2. А показывают, что обработка эстрогеном индуцирует образование овальбуминовой мРНК. Не менее важны другие опыты с использованием кДНК-зонда, в которых было показано, что эстроген стимулирует появление последовательностей, кодирующих овальбумин, в ядре (Roop et al., 1978; табл. 11.2. Б). Таким образом, синтез овальбумина в клетках стенки магнума регулируется в первую очередь на уровне транскрипции гена. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2025 stydopedia.ru Все материалы защищены законодательством РФ.
|