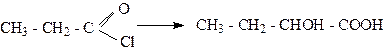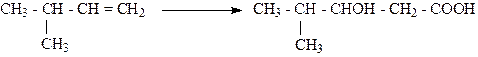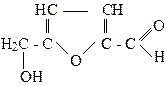|
|
Виннокаменной кислоты. Доказательство наличия двух карбоксильных групп в виннокаменной кислоте.В пробирку поместить 1 каплю 2н. раствора виннокаменной кислоты, 2 капли 0,5н. КОН и хорошо встряхнуть. Постепенно начинает выпадать белый, явно кристаллический осадок кислой калиевой соли, т.к. она менее растворима в воде, чем сама виннокаменная кислота. Добавить в пробирку еще 4-5 капель раствора КОН, чтобы получить заведомый избыток щелочи. Кристаллический осадок постепенно растворяется, т.к. образуется средняя калиевая соль, относительно хорошо растворимая в воде. Полученный раствор сохранить для следующего опыта. Образование двух различных по физическим свойствам калиевых солей служит доказательством наличия двух карбоксильных групп виннокаменной кислоты.
Опыт 9.3 Доказательство наличия гидроксильных (окси) групп в Виннокаменной кислоте. Поместить в пробирку 2 капли 0,2н. CuSO4 и 2 капли 2н. NaOH. Сразу выпадает голубой осадок гидрата окиси меди. Добавить к нему раствор средней калиевой соли виннокаменной кислоты, полученной в опыте . Происходит растворение голубого осадка и образование синего раствора. Убедитесь, что при нагревании он не изменится. Известно, что гидрат окиси меди в присутствии избытка едкой щелочи при нагревании до кипения легко отщепляет воду и выделяет окись меди желтого цвета. В противоположность этому полученный щелочной раствор комплексного медного соединения виннокаменной кислоты при кипячении не разрушается и не выделяет черного осадка меди. Это позволяет применить щелочные растворы для открытия альдегидов или виноградного сахара. Опыт 9.4 Расщепление лимонной кислоты под действием концентрированной серной кислоты (доказательство строения лимонной кислоты) В сухую пробирку А (с газоотводной трубкой) поместить немного лимонной кислоты, 1 мл концентрированной серной кислоты и нагреть. Конец газоотводной трубки опустить в пробирку с 3-5 каплями баритовой воды. Когда баритовая воды помутнеет, поджечь второй продукт разложения у отверстия трубки, а затем снова опустить газоотводную трубку (продолжая нагревание пробирки А) в пробирку Б, где заготовлен раствор иода в иодиде калия, почти полностью обесцвеченный добавлением нескольких капель 2н. NaOH. Образуется желтоватый осадок с характерным запахом. Запишите структурную формулу лимонной кислоты, схему ее разложения и схемы реакций, с помощью которых обнаруживают продукты расщепления. Лимонная кислота – нормальный продукт обмена веществ в организме «цикл лимонной кислоты», она используется для приготовления так называемой цитратной плазмы крови, некоторых лекарств и в пищевой промышленности. Вопросы для контроля 1. Определение и номенклатура оксикислот. 2. Классификация и изомерия оксикислот. 3. Химические свойства оксикислот. 4. Отношение к нагреванию оксикислот. 5. Методы получения оксикислот.
Упражнения по теме «Оксикислоты» 1. Напишите структурные формулы оксикислот состава С4Н8О3 и назовите их по систематической номенклатуре. 2. Напишите уравнения реакций, с помощью которых можно осуществить превращение ацетилена в 2-оксипропановую кислоту. 3. Получите любым способом 2-окси-3,3-диметилбутановую кислоту. Для полученной оксикислоты напишите реакции с HCl и NaOH. 4. Получите из пропановой кислоты молочную кислоту и напишите для последней реакции с этаналем и этиловым спиртом. 5. Напишите схему превращений:
6. Какое соединение образуется при нагревании 2-окси-2-метилбутановой кислоты? Назовите полученные соединения. 7. Из пропаналя через продукт альдольной конденсации получите 3-окси-2-метилпентановую кислоту. 8. Напишите уравнения реакций 2-метилпропаналя, 4-метилгексанона-3 с синильной кислотой. Проведите гидролиз продуктов присоединения и назовите полученные соединения. 9. Напишите схемы реакции окисления оксикислот: а) a-оксипропановой; б). g-оксимасляной Назовите образующиеся соединения. 10. На лактон g-оксимасляной кислоты подействуйте водным раствором NaOH. Назовите образующееся соединение. 11. Напишите схемы реакций взаимодействия избытка хлористого водорода с кислотами: а) оксиуксусной; б) a-оксипропановой 12. Напишите уравнения реакций между: а) оксиуксусной кислотой и NaOH; б) g-оксимасляной и Ca(OH)2 13. Предложите схему синтеза винной кислоты из этена и неорганических реагентов. 14. Из масляной кислоты получите a- оксимасляную. Какое соединение получится при обработке ее HCl? 15. Напишите схему превращений:
Углеводы
Углеводы – органические соединения, содержащие в молекуле одновременно альдегидную или кетонную группу и несколько спиртовых групп. Все углеводы разделяются на две большие группы: I Простые углеводы (моносахариды или монозы). Эти углеводы не подвергаются гидролизу с образованием более простых углеводов. II Сложные углеводы (полисахариды или полиозы). Эти углеводы подвергаются гидролизу и образуют при этом простые сахара.
МОНОСАХАРИДЫ Химические свойства моносахаридов определяются присутствием в их молекулах оксогруппы и спиртовых гидроксилов. Все моносахариды, подобно альдегидам и кетонам, при восстановлении образуют спирты. В зависимости от характера окислителя могут образовываться одноосновные или двухосновные кислоты. При нагревании глюкозы, маннозы и фруктозы образуется один и тот же озазон. Действие алкилирующих агентов на моносахариды приводит к образованию неполных и полных простых эфиров. В результате ацилирования образуются сложные эфиры.
Лабораторная работа
Цель работы: изучение физических и химических свойств простых сахаров Реактивы и оборудование: 2н – NaOH, 2н – NH4OH, 0,5% - глюкозы, 0,5% - фруктозы, 0,2н – CuSO4, 0,2н – AgNO3, резорцин сухой, HCl (конц)., пробирки, спиртовки. Опыт 10.1Доказательство наличия гидроксильных групп в глюкозе Поместить в пробирку 1 каплю 0,5%-го раствора глюкозы и 6 капель 2н. NаОН. К полученной смеси добавить 1 каплю 0,2н. раствора СuSО4. Образующийся в начале осадок гидрата окиси меди Сu(ОН)2 немедленно растворяется и получается прозрачный раствор сахарата меди со слабой синей окраской. Растворение гидрата окиси меди указывает на наличие гидроксильных групп в глюкозе. Полученный раствор сохранить для следующего опыта. Сравните приведенную реакцию с реакцией образования глицерата меди, а также с реакцией образования комплексной соли виннокаменной кислоты. Опыт 10.2 Восстановление гидрата окиси меди глюкозой В присутствии щелочи К полученному в предыдущем опыте щелочному синему раствору сахарата меди добавить несколько капель воды так, чтобы высота слоя жидкости составляла 18-20 мм. Нагреть ее над пламенем микрогорелки, держа пробирку так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась для контроля без нагрева. Нагреть только до кипения, так как глюкоза восстанавливает гидрат окиси меди уже в таких условиях, т. е. без кипячения. Через несколько секунд нагретая часть раствора меняет свой синий цвет на оранжево-желтый, так как образуется гидрат закиси меди. При несколько большем содержании едкой щелочи или более продолжительном нагревании гидрат закиси меди может отщепить воду и образовать желто-красный осадок закиси меди Сu2О. Выделяющийся при восстановлении гидрата окиси меди кислород идет на окисление глюкозы. Процесс этот весьма сложный и, судя по наличию ряда кислот, выделенных из продуктов реакции окисления, сопровождается глубоким расщеплением молекулы глюкозы. Опыт 10.3 Восстановление аммиачного раствора окиси серебра глюкозой Поместить в пробирку 1 каплю 0,2н. AgNO3, раствор подщелочить, прибавив 2 капли 2н. раствора NaОН, и добавить (по каплям) 3-4 капли 2н. раствора NH4ОН до растворения образующегося осадка гидрата окиси серебра. Полученный прозрачный бесцветный раствор гидрата окиси серебра является реактивом, которым можно окислить глюкозу (реакция серебряного зеркала). Для этого добавить к реактиву 2 капли 0,5%-го раствора D-глюкозы и слегка подогреть пробирку, держа ее над пламенем горелки, только до начала побурения раствора. Далее реакция идет без нагревания, и металлическое серебро выделяется либо в виде черного осадка, либо, если стенки пробирки были чисты, в виде блестящего зеркального налета. Отсюда и название реакции "серебряного зеркала". Освобождающийся при восстановлении окиси серебра кислород идет на окисление глюкозы. Процесс этот очень сложен и сопряжен с распадом глюкозы. Нужно помнить, однако, что в условиях лабораторного анализа получение зеркального налета отнюдь не является обязательным. Простое побурение бесцветного реактива уже является положительной реакцией. ' Реакция восстановления аммиачного раствора окиси серебра глюкозой применяется в технике серебрения зеркал. При этом большое значение имеет тщательная очистка поверхности стекла (обезжиривание). Опыт 10.4 Реакция Селиванова на фруктозу Поместить в пробирку крупинку сухого резорцина и 2 капли концентрированной соляной кислоты. Добавить 2 капли 0,5%-го раствора фруктозы и нагреть до начала кипения. Постепенно жидкость приобретает красное окрашивание. Реакция обусловлена образованием нестойкого соединения - оксиметилфурфурола.
Под влиянием концентрированной соляной кислоты последний конденсируется с резорцином давая окрашенное соединение. Реакция Селиванова характерна для фруктозы (и для других кетогексоз) только при выполнении указанных выше условий.
Вопросы для контроля 1. Классификация углеводов на D- и L-ряды. 2. Особенности строения моносахаридов (карбонильные и циклические формы). 3. Химические свойства моносахаридов. 4. Явление мутаротации. 5. Получение гликозидов.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|