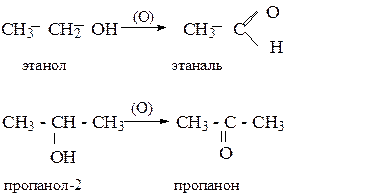|
|
Упражнения по теме «Галогенопроизводные углеводородов»1. Напишите структурные формулы всех галогенозамещенных с формулой С5Н11Cl. Назовите эти соединения по номенклатуре ИЮПАК. 2. Напишите уравнения реакций взаимодействия 2-бромбутана со следующими соединениями: а) магнием; б) аммиаком; в) цианистым калием; г) водным и спиртовым раствором щелочи. 3. Из пропина получите 1-хлорпропен-2. 4. Из этина получите 2-хлорбутадиен-1,3-хлоропрен. 5. Из метана получите этановую кислоту, используя реактив Гриньяра. 6. Получите хлорэтен (CH2 = CH – Cl), исходя из этена и этина. 7. Из бензола получите 2,4-динитрохлорбензол и 2,5-дихлорнитробензол. 8. Напишите схемы реакций полимеризации: а) хлористого винила; б) 2-хлор-1,3-бутадиена. 9. Из этаналя получите бромоформ (CHBr3). 10. Напишите схему следующих превращений: СН3 – СН2 – СН2 – СН3 Назовите соединения А, Б, В, Г, Д. 11. Из этана получите хлорэтен (CH2 = CH – Cl). 12. Из дибромэтана получите 1,2-дибромбензол. 13. Из этина получите 1-бром-4-хлорбензол. 14. Как осуществить следующие превращения:
б) СН3 – СН = СН2 СН3-СН2 – СН2 - Br в) СН3 – (СН2)4 – СН3 г) СН3 – СН2 – СН2 – СН3 д) СН3 – СН2 – СН3
n-хлортолуол и хлористый бензил? Спирты
Спирты или алкоголи-производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на соответствующее число гидроксильных групп. Химические свойства спиртов определяются реакционноспособной гидроксильной группой и строением связанного с ней радикала. Реакции, в которые вступают спирты, можно разбить на следующие группы: I. Реакции идущие с участием только атома водорода гидроксильной группы (разрыв связи О – Н). II. Реакции, происходящие с замещением или отщеплением всей гидроксильной группы (разрыв связи С – О) III Реакции окисления, в которых одновременно принимают участие гидроксильная группа, a-водородные атомы или соседние связи углерод – углерод. Спирты – практически нейтральные вещества. Однако, атом водорода гидроксильной группы, обладая некоторой подвижностью, способен вступать в реакции замещения. Кислород как более электроотрицательный элемент, оттягивая электронную плотность в свою сторону, способствует поляризации связи О – Н: d- d+ R – O H В результате происходит замещение атома водорода на щелочные или, при соответствующих условиях, на другие металлы (Ca, Al, Mg). По способности отщепления водорода спирты можно расположить в такой ряд: первичные ® вторичные ® третичные. При окислении спиртов образуются различные продукты. Первичные спирты при этом переходят в альдегиды, а вторичные – в кетоны:
Третичные спирты наиболее стойки к действию окислителей. Поэтому при их окислении в жестких условиях происходит расщепление молекулы с образованием смеси кислот.
Лабораторная работа
Цель работы: Изучение химических свойств спиртов. Реактивы и оборудование: 2н. H2SO4; 0,5н. K2Cr2O7; 2н. NaOH; 0,2н. CuSO4; 2,4-динитрофенилгидразин; глицерин, фенолфталеин, 1%-ный спиртовый раствор; этанол; натрий металлический; ацетат натрия (обезв.). штатив с пробирками; держателль для пробирок; скальпель; пинцет; фильтровальная бумага; спиртовка. Опыт 4.1 Получение этилата натрия Помещают в пробирку маленький кусочек металлического натрия (кубик 2х2х2 мм). Добавляют 3 капли этанола и закрывают отверстие пробирки пальцем. Что наблюдается? По окончании реакции, не отрывая пальца от отверстия пробирки, подносят ее к пламени спиртовки. При открытии пробирки водород воспламеняется, образуя маленькое колечко голубоватого цвета. На дне пробирки остается беловатый осадок этилата натрия. От прибавления 2-3 капель воды осадок растворяется (примечание 1). При добавлении 1 капли фенолфталеина раствор окрашивается? Почему? Примечание 1. Иногда наблюдается очень незначительная вспышка за счет ничтожных остатков непрореагировавшего натрия, если его было взято больше, чем надо. Опыт 4.2 Реакция глицерина с гидратом окиси меди в щелочной среде Помещают в пробирку 3 капли 0,2н. CuSO4, 3 капли 2н. NaOH и взбалтывают. Что при этом наблюдается? Полученный раствор нагревают. Что при этом происходит и почему? Опыт повторяют, но перед кипячением гидроксида меди добавляют в пробирку 1 каплю глицерина. Полученный раствор нагревают на пламени спиртовки. Сравнить наблюдаемые эффекты и дать их объяснение. Выводы подтвердить уравнениями химических реакций. Опыт 4.3 Окисление этанола хромовой смесью Помещают в пробирку 2 капли этанола и добавляют 1 каплю 2н H2SO4 и 2 капли 0,5н. K2Cr2O7. Полученный оранжевый раствор нагревают над пламенем микрогорелки до начала изменения цвета. Обычно уже через несколько секунд цвет раствора становится синевато-зеленым (цвет солей оксида хрома (III)). Одновременно ощущается характерный запах этаналя. Для подтверждения его образования в пробирку с каплей полученного раствора вводят 3 капли этанола и 3 капли раствора 2,4-динитрофенилгидразина. Образование альдегида подтверждается выпадением оранжевого осадка. Написать уравнение реакции. Опыт 4.4 Получение диэтилового эфира В сухую пробирку помещают 2 капли этанола и 2 капли концентрированной серной кислоты. Пробирку осторожно нагревают до начала незначительного побурения раствора. Образование диэтилового эфира можно обнаружить по характерному запаху. К горячей смеси добавляют еще 2 капли этанола. Без дополнительного нагревания образуется новая порция диэтилового эфира, запах его становится более заметным. Сравните его с запахом готового диэтилового эфира. Опыт 4.5 Получение этилового эфира этановой кислоты В сухую пробирку помещают немного (высота слоя около 2 мм) порошка обезвоженного ацетата натрия и 3 капли этанола. Добавляют 2 капли концентрированной серной кислоты (в вытяжном шкафу) и осторожно нагревают над пламенем спиртовки. Через несколько секунд появится характерный приятный освежающий запах уксусноэтилового эфира. Напишите уравнение реакций.
Вопросы для контроля 1. Определение, классификация и номенклатура спиртов. 2. Способы получения спиртов. 3. Особенности строения и химические свойства спиртов. 4. Окисление спиртов. 5. Качественные реакции на двух- и трехатомные спирты.

Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 А
А 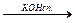 Б
Б  В
В  Г
Г 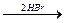

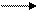
 а) СН3 – С º СН
а) СН3 – С º СН 15. С помощью каких реакций можно различить изомерные соединения:
15. С помощью каких реакций можно различить изомерные соединения: