
|
|
ЭЛЕМЕНТЫ У1 ГРУППЫ ПОБОЧНОЙ ПОДГРУППЫВ подгруппу входят хром, молибден, вольфрам и рений.
 Характерная степень окисления +6, наряду с этим хром дает устойчивые соединения со степенью окисления +3, молибден +4. В других степенях окисления (+2, +4, +5) хром и его аналоги образуют неустойчивые соединения и имеют несколько степеней окисления. На свойства вольфрама оказывает влияние лантаноидное сжатие. Радиусы вольфрама и молибдена близки, по свойствам они менее отличаются друг от друга, чем от хрома. От хрома к вольфраму химическая активность элементов уменьшается. Характерная степень окисления +6, наряду с этим хром дает устойчивые соединения со степенью окисления +3, молибден +4. В других степенях окисления (+2, +4, +5) хром и его аналоги образуют неустойчивые соединения и имеют несколько степеней окисления. На свойства вольфрама оказывает влияние лантаноидное сжатие. Радиусы вольфрама и молибдена близки, по свойствам они менее отличаются друг от друга, чем от хрома. От хрома к вольфраму химическая активность элементов уменьшается.
Природные ресурсы. В земной коре содержится: Cr -3,5 · 10-2 %, Mo – 1,1 · 10-4 % и W – 10-4 %. Основные минералы: Fe(CrO2)2 – хромистый железняк, PdCrO4 - крокоит, MoS2 - молибденит, CaWO4 – шеелит, WO3 – вольфрамовая охра, (Fe, Mn) WO4 – вольфрамит. Получение. Хром, молибден и вольфрам получают из природных соединений в виде металлов и в виде ферросплавов, которые непосредственно используются для легирования сталей. Феррохром: Fe(CrO2)2 + 4C = Feº +2Crº + 4CO; tº Cr2O3 + 2Al = Al2O3 + 2Cr; tº 2Cr2O3 + 3 Si + CaO = 4Cr + 3CaSiO3.
Физические свойства. В свободном состоянии элементы подгруппы хрома – серебристо – белые блестящие парамагнитные металлы с очень высокой температурой плавления, которая растет от хрома к вольфраму, W – самый тугоплавкий из всех известных металлов. Плотность металлов увеличиваетсяот хрома к вольфраму,в этом же ряду снижается способность металлов переходить в пассивное состояние за счет образования на поверхности металла оксидной пленки. Химические свойства. В ряду напряжений хром, молибден и вольфрам расположены до водорода, однако в обычных условиях они малоактивны. Хром взаимодействует с разбавленными НС1О4 и H2SO4 , молибден к ним устойчив. Концентрированные H2SO4 и HNO3 и царская водка на холоде пассивируют хром; горячие окисляют хром до солей хрома (111), а молибден до молибденовой кислоты. Вольфрам устойчив ко всем кислотам за исключением царской водки и смеси HNO3 + НF, например : Cr + H2SO4 + 6H2O = [Cr(H2O)6] SO4 + H2↑ 2Cr + 6 H2SO4 (конц.) = Cr2(SO4)3 + 3SO2 +6H2O Mo + 2HNO3 + 2 H2O = H2MO4 +2NO W + 2НNO3 + 8 HF = H2[WF8] + 2 NO + 4 H2O Хром, молибден и вольфрам могут быть переведены в раствор методом окислительного щелочного сплавления с образованием, соответственно, хроматов, молибдатов и вольфраматов, например:
1 Э +_ 8ОН - - 6 е = _ ЭO42- + 4 H2O 3 NО3 + H2O +2е = NО2 + 2ОН - Э + 8ОН - + 3NО3 + 3 H2O = ЭO42- + 4 H2O + 3NО2 + 6ОН - Растворы щелочей на данные металлы практически не действуют. Соединения хрома в степени окисления +2. Для хрома известно лишь небольшое число бинарных соединений в степени окисления +2, которые получают восстановлением соединений Cr3+ . Оксид хрома (11) получить очень трудно. Бинарные соединения хрома проявляют основные свойства. Соединения хрома в степени окисления +2 обладают большой востановительной способностью. В при отсутствии окислителя восстанавливают воду, постепенно разлагая ее с выделением водорода: 2CrCI2+2H2О= 2Cr ОНCI2+ H2.
Соединения хрома в степени окисления +3. Для хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (111) равно шести, его комплексы имеют структуру октаэдра. Оксид хрома ( III ) –химически устойчивый, нерастворимый в воде и кислотах зеленый порошок. Он тугоплавок, твердоссть его кристаллов соизмерима с твердостью корунда. Оксид хрома (111) можно получить по следующим реакциям:
Амфотерная природа Сr2О3 проявляется при сплавлении со щелочами и пи-росульфатом калия: tº
Оксиду Cr2O3 соответствует гидроксид хрома (111) [Cr(OH)3] n – это много-ядерный слоистый полимер серо-зеленого цвета, в котором роль лигандов играют ионы гидроксила и молекулы воды, а роль мостиков - группы ОН- . Его состав и структура зависят от условий получения. При старении и особенно при нагревании, гидроксид хрома. Свежеосажденный гидроксид хрома хорошо растворяется в кислотах и щелочах, которые вызывают разрыв связей в слоистом полимере: Cr(OH)3 + 3HCl + 3 H2O = [Cr(H2O)6]Cl3 Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Для солей хрома характерна гидратная изомерия, в зависимости от числа моль воды во внутренней сфере они окрашены в разные цвета, например, [Cr(H2O)5Cl]Cl2-светло-зеленый [Cr(H2O)4Cl2]Cl·2H2O – темно – зеленый, Соли хрома легко подвергаются гидролизу :
2 CrCl3 + 3Na2СO3 +3H2O = 2Cr (OH )3 + 3CO2 + 6NaCl Хром (III) весьма склонен к образованию комплексов как анионного, так и катионного типа, координационное число равно шести, что соответствует d2sp3 – гибридизации.
2 Cr 3+ + 8 ОН- -3е = CrO4 2- + 4Н2О 3 Н2О2 –2е = 2ОН- 2Cr 3+ + 16ОН- + 3Н2О2 = 2CrO4 2- + 8Н2О – 6ОН- 2 Na [Cr(OH)6] 3- +6Br2 +4NaОН = Na2CrO4 +6NaBr +8Н2О 2 [Cr(OH)6] 3- +2ОН- -3е = CrO4 2- + 4Н2О 3 Br2 +2e = 2Br - 2 [Cr(OH)6] 3- +4ОН- + 3Br2= 2CrO4 2- + 8Н2О + 6Br- -
Соединения хрома степени окисления +6. Соединения хрома в степени окисления +6 многочисленны. Соединения с низкими степенями окисления длямолибдена и вольфрама неустойчивы и мало изучены. Оксид CrO3 получают по реакции: K2Cr2O7 ( тверд.) + H2SO4 (КОНЦ) = K2 SO4 + 2 СrО3 + H2O. CrO3 – оксид темно-красного цвета, имеет цепочечную структуру, образованную тетраэдрами CrO4 . При нагревании CrO3 довольно легко разлагается с выделением кислорода:
Со многими окисляющимися веществами CrO3 взаимодействует со взрывом. CrO3 – ядовит! CrO3 легко растворяется в воде, образуя хромовую кислоту : CrO3 + Н2О = Н2CrO4 . Хромовая кислота в свободном виде не выделена, она существует только в водном растворе. Кислотная природа оксидов проявляется при растворении в щелочах: CrO3 + 2КОН = К2 ЭO4 + H2O. В воде растворимы хроматы, s-элементов первой группы, а также магния и кальция. При действии кислот на хроматы образуются полихроматы, при этом желтая окраска хроматов изменяется на оранжевую. 2H+ + 2CrO42- ↔ Cr2O72- + H2O. В результате дальнейшего подкисления раствора концентрированной кислотой при охлаждении выделяются темно- красные кристаллы CrO3 : K2Cr2O7 + H2SO4 = 2CrO3 + K2SO4 + H2O. Если же на растворы полихроматов действовать щелочью, процесс идет в обрат-ном направлении : Cr2O72- + 2 OH¯ = 2CrO42- + H2O. Из оксохроматов наибольшее значение имеют соли натрия и калия, которые получают сплавлением Cr2O3 с соответствующими карбонатами на воздухе при 1000-13000С. Cr2O3 + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2. Все соли, содержащие Сr (VI), являются сильными окислителями. В кислой среде образуются производные катионного комплекса [Cr(H2O)6]3-: K2Cr2O7 +3Na2SO4 +4H2SO4 =Cr2(SO4)3 + 3Na2SO4 + K2SO4 +4H2O 1 Cr2O7 2- +14 H+ +6е = 2Cr3+ + 7H2O 3 SO32- + H2O – 2е = SO4 2- + 2H+ Cr2O7 2- +14 H+ + 3SO32- + 3H2O = 2Cr3+ + 7H2O + 3SO4 2- + 6H+
Лекция 8 ЭЛЕМЕНТЫ II ГРУППЫ ПОБОЧНОЙ ПОДГРУППЫ В подгруппу входят цинк, кадмий и ртуть.
Вследствие особой устойчивости электронных конфигураций– d10, Zn, Cd и Hg в своих соединениях проявляют степень окисления +2. На свойства ртути оказывает влияние лантаноидное сжатие и более высокая устойчивость 6s2 электронов, в частности, большинство соединений ртути малоустойчивы, в противоположность соединениям Zn и Cd. В отличие от Zn и Cd для ртути характерны производные радикала [Hg2]2+, в которых атомы ртути связаны между собой ковалентной неполярной связью между двумя атомами ртути –Hg–Hg– . В производных [Hg2]2+ степень окисления Hg принимают равной + 1. Природные ресурсы. В земной коре содержится: Zn - 5·10-3%, Cd - 5·10-5%, Hg - 7·10-6%. Из d – металлов II группы только Hg встречаются в свободном состоянии, Zn и Cd встречаются только в виде соединений. Важнейшие минералы Zn, Cd и Hg: цинковая обманка ZnS, гринокит СdS, киноварь HgS, смитсонит ZnCO3. Получение. Получение Zn из ZnS ведут двумя путями. Гидроэлектрометаллургический: окисление: 2ZnS + 3O2 = 2ZnO + 2SO2↑ обработка H2SO4 разб.: ZnS + H2SO4 = ZnSO4 + H2O электролиз раствора ZnSO4 : K(–) Zn2+ + 2ē =Zn0 Данный метод целесообразен при рудах с малым содержанием металла. Пирометаллургический : ZnS + 3O2 = 2ZnO + 2SO2↑ ZnO + C = Zn↑ + CO↑ Цинк ( в парах ) и СО удаляют из сферы реакции. В рудах Сd обычно сопутствует Zn и его отделяют при переработке цинковых руд. Отделение кадмия от цинка производят разгонкой. Ртуть получают прямым окислением киновари: HgS + O2 = Hg + SO2. Применение До 40% мирового производства цинка расходуется на защиту железа и стали от коррозии. Цинк применяется как восстановитель в химической технологии, идет на изготовление сплавов: латуней (сплав цинка с медью), алюминиевых сплавов и сплавов на основе никеля. Кадмий входит в состав легкоплавких сплавов. Соли кадмия используются в производстве стекла, люминофоров, синтетического каучука, в полупроводниковой промышленности в качестве материала для фотоэлементов и фототранзисторов. Ртуть используется в органическом синтезе, для изготовления ртутных монометров, ламп дневного света, для мощных выпрямителей, в медицине. Свойства простых веществ Цинк и кадмий – серебристо–белые металлы, во влажном воздухе они постепенно покрываются тонким слоем оксида и теряют блеск. Ртуть – единственный металл, находящийся в жидком состоянии при комнатной температуре. В подгруппе цинка с ростом атомной массы химическая активность металлов падает, так цинк легко взаимодействует с кислотами и при нагревании с водными растворами щелочей ( щелочь снимает оксидную пленку с поверхности цинка ): Zn + 2HCl + 4H2O = [Zn(H2O)4]Cl2 + H2↑ 1│ Zn − 2ē + 4H2O→ [Zn(H2O)4]2+ 1│ 2H+ + 2ē→ H2 Zn + 4H2O + 2H+ → [Zn(H2O)4]2+ + H2 ; Zn + 2NaOH + 2H2O =Na2[Zn(OH)4] + H2↑ │ Zn − 2ē + 4ОН‾ → [Zn(OH)4]2‾ │ 2H2O +2ē → H2 + 2ОН‾ Zn + 4ОН‾ + 2H2O → [Zn(OH)4]2‾ + H2 + 2ОН‾ Кадмий в растворах щелочей практически не растворяется, в кислотах растворяется, но менее энергично, чем цинк. Цинк и кадмий легко взаимодействуют с азотной и концентрированной серной кислотами: 3Zn + 4H2SO4(К0НЦ.) = 3ZnSO4 + S↓ + 4H2O; 4Zn + H2SO4(КОНЦ.) = 4ZnSO4 + H2S↑ +4H2O. очень разбавленную HNО3 цинк восстанавливает до иона аммония: 4Zn + 10 HNO3 ( оч.разб.)= 4Zn(NO3)2 + NH4NO3 + 3H2O 4│ Zn − 2ē → Zn2+ 1 │NO3‾ + 8ē + 10Н+ → NH4+ + 3H2O 4 Zn + NO3‾ + 10Н+ → 4 Zn2+ + NH4+ + 3H2O
а нитраты в щелочной среде – до аммиака: 4Zn + KNO3 + 7KOH + 6H2O = 4K2[Zn(OH)4] + NH3 4 │ Zn − 2ē + 4ОН‾ → [Zn(OH)4]2‾ 1│ NO3‾ + 8ē + 6Н2О→ NH3 + 9OН- 4Zn + 16ОН‾ + NO3‾ + 6Н2О → 4[Zn(OH)4]2‾ + NH3 + 9OН-
Ртуть, как это видно из значения ее электродного потенциала, ( Е=+0,850В) стоит за водородом , поэтому в водных растворах бескис-лородных кислот не растворяется. Ртуть растворяется только в кислотах – окислителях, при этом могут получаться производные как Hg(II), так и Hg(I): Hg + 4 HNO3(конц.) = Hg(NO3)2 + 2NO2 + 2H2O 1│ Hg − 2ē → Hg2+ 2│ NO3‾ + ē + 2Н+ → NO2 + H2O Hg + 2 NO3‾ + 4Н+ → Hg2+ + 2 NO2 + 2 H2O 6Hg + 8 HNO3(разб .) = 3Hg2(NO3)2 + 2NO+ 4H2O 3│2Hg − 2ē → [Hg 2 ] 2+ 2│ NO3‾ + 3ē + 4Н+ → NO + 2H2O 6Hg + 2 NO3‾ + 8Н+ → [Hg 2 ] 2+ + 2 NO + 4H2O Оксиды цинка ZnО, кадмия СdO можно получить при непосредствен-ном взаимодействии металлов с кислородом: 2Zn + O2 = 2ZnO; 2Cd + O2 = 2CdO, тогда как оксиды ртути ( I) и (II) получаются косвенным путем. В ряду ZnО, СdO, HgО термическая устойчивость оксидов уменьшается, окраска усиливается. В воде оксиды практически не растворимы. ZnО – амфотерен, а оксиды СdO, HgО, Hg2O обладают основными свойствами. При нагревании Zn, Сd, Hg энергично взаимодействуют с активными неметаллами. Сульфиды в воде практически нерастворимы, в ряду ZnS – CdS – HgS растворимость понижается. ZnS + 2HCl(p.) = ZnCl2 + H2S↑ CdS+ 4 HCl(K.)= H2[CdCl4] + H2S↑ 3HgS + 8HNO3 = 3Hg(NO3)2 +3S↓ + 2NO +4H2O С водородом Zn, Сd, Hg химически не реагируют, гидриды ЭН2 получают при взаимодействии иодидов этих металлов с алюмогидридом лития в среде диэтилового эфира: 2 ЭI2 + SiAlH4 = 2ЭН2 + SiI+ AlI3. ZnН2, СdН2, HgН2 – твердые малоустойчивые вещества. Цинк, кадмий и ртуть образуют сплавы как друг с другом, так и с другими металлами. Для ртути характерно образование амальгам, которые можно получить при растирании или перемешивании металла с ртутью. Свойство ртути образовывать амальгаму золота используется для извлечения золота. Амальгама натрия NanHgm применяется в качестве восстановителя. 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

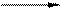 Э+ 3NаNО3 + 2NаОН СПЛАВ Na2ЭO4 + 3 NaNO2 + Н2О
Э+ 3NаNО3 + 2NаОН СПЛАВ Na2ЭO4 + 3 NaNO2 + Н2О Na2Cr2O7 + 2C tº Cr2O3 + Na2CO3 + CO
Na2Cr2O7 + 2C tº Cr2O3 + Na2CO3 + CO (NH4)2Cr2O7 tº Cr2O3 + N2 + 4 H2O
(NH4)2Cr2O7 tº Cr2O3 + N2 + 4 H2O Cr2O3 + 2NaОН 2 NaCrO2 + Н2O
Cr2O3 + 2NaОН 2 NaCrO2 + Н2O Cr2O3 + 3 K2S2O3 tº Cr2(SO4 )3 + 3K2SO4
Cr2O3 + 3 K2S2O3 tº Cr2(SO4 )3 + 3K2SO4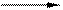 K2S2O3 K2SO4 + SO3
K2S2O3 K2SO4 + SO3 Cr2O3 + 3SO3 tº Cr2 (SO4 )3
Cr2O3 + 3SO3 tº Cr2 (SO4 )3 [Cr(H2O)6]Cl3 –фиолетовый ,
[Cr(H2O)6]Cl3 –фиолетовый ,

 Соединения Сr3+ являются восстановителями :
Соединения Сr3+ являются восстановителями : 4CrO3 2Cr2O3 + 3O2↑ ,
4CrO3 2Cr2O3 + 3O2↑ ,