
|
|
Сульфид-ион характеризуется сильными восстановительными свойствам-2 +7 3Na2S +2KMnO4+4H2O=3S0+2Mn+4O2+2KOH+2NaOH
3 _S2- -2е=S__________________________ 2MnO-4+4H2O+3S2 -=2MnO2+8OH-+3S. Способность серы к образованию гомоцепей проявляется в полисульфидах водорода или сульфанах H2Sn где n= 2- 23 , которые образуются при взаимодей-ствии серы с сульфидом активного металла: Na2S+2S Ион S2-3 имеет строение
Степень окисления +2 для серы не характерна; соединения малочисленны и большого практического значения не имеют. Степень окисления +4 Степень окисления +4 сера проявляет в соединениях с более электроотри-цательными элементами: кислородом в оксиде серы IV- S02 , сульфит- S032- и гидросульфит HSO3- -ионах, а также в тетрагалогенидах например, SF4 и оксогалогенидах – SOCl2. Важнейшим из соединений серы (IV) является оксид SO2. Его получают в промышленности: 1) сжиганием свободной серы S S+O2 2) обжигом пирита FeS (персульфид железа). 4 FeS2 + 11O2 = 2 Fe2O3 + 8SO2 11 O2 +4e = 2O-2 4 FeS2 -11e = Fe3+ + 2S+4 Большое количество SO 2 выделяется при горении топлива, при производстве чугуна и стали, поэтому улавливание SО2 является важнейшей природоохранной задачей. В лабораторных условиях оксид серы (II) получают: 1)при взаимодействии неактивных металлов с концентрированной H2SO4: Cu+2H2SO4КОНЦ=CuSO4+2H2O+SO2; 2) при взаимодействии сульфитов с разбавленными кислотами: Na2SO3+2HCl=2NaCl+H2O+SO2; 3) при действии концентрированной H2SO4 на уголь, серу: C+2H2SO4КОНЦ=CO2+2SO2+2H2O. Оксид серы (IV) применяется для обесцвечивания органических красящих веществ при отбеливании тканей, бумаги, кож, для дезинфекции помещений. Дезинфици-рующие свойства SО2 основаны на его способности убивать микроорганизмы. В связи с этим его применяют для окуривания винных и пивных бочек, складов, под-валов, тары и т.д.
Оксид серы (IV) хорошо растворим в воде, при этом образуется сернистая кислота, которая существует только в растворе: SO2+H2O Константы ионизации при 20 °С по I ступени - 2.10 –2, по II ступени - 6.10-8. Сернистая кислота образует два ряда солей: средние – сульфиты и кислые – гидросульфиты. Сульфиты, представляют собой бесцветные вещества, мало растворимы в воде ( за исключением сульфитов щелочных металлов). Растворимые в воде сульфиты подвергаются гидролизу : Na2SO3+HO В окислительно-восстановительных реакциях соединения серы (1У) могут проявлять как восстановительные, так и окислительные свойства, способны к реакциям диспропорционирования :
5 SO32- – 2ē + Н2О → SO4 2- + 2Н+ 2 MnO4¯+16Н+ +5 SO32- + 5Н2О → Mn2+ +8H2O + SO4 2- + 10Н+
Na2SO3 + Na2S + H2SO4 → 2 S + 5Na2SO4 + 3H2O
2 S 2- -2e = S0 4SO32- +6 H+ + 2S2- = S0+3H2O+ 2S0
4 Na2SO3= Na2S +3Na2SO4
Степень окисления +6 Высшую степень окисления сера проявляет в оксиде серы(VI), гекса-фториде серы, в оксогалогенидах, серной кислоте и ее производных. Оксид серы (VI) - летучая жидкость с т. кип.44,80С. Известно несколько кристаллических форм SO3. Находящиеся в газовой фазе молекулы SO3 неполярны, имеют вид равностороннего треугольника, угол связи равен 1200.
При нагревании SO3 разлагается 2SO3 С водой реагирует, выделяя большое количество тепла: SO3+H2O=H2SO4+Q. При взаимодействии с HCl образуется хлорсульфоновая кислота, которая легко гидролизуется: HSO3Cl+H2O=H2SO4+HCl. SOз - сильный окислитель: 2KJ+SO3=J02+K2SO3. Важнейшим соединением шестивалентной серы является серная кислота. Химически чистая H2SO4 - маслянистая, бесцветная жидкость, замерзавшая при 10,4 °С. В промышленных условиях серную кислоту получают контактным и нитрозным методами. При контактном способе оксид серы (IV) при нагревании в присутствии катализатора V2O5, Рt окисляют кислородом воздуха до оксида серы (VI), а затем его направляют в поглотительные башни, где SO3 растворяется в серной кислоте, образуя олеум. 75-процентную кислоту получают нитрозным способом по уравнению: NO2+SO2+H2O=H2SO4+NO. Выделившийся NО окисляется в оздухом до NО2 и снова используется в производстве. Работа с концентрированной H2SO4 требует большой осторожнос-ти, так как попадание кислоты на кожу вызывает болезненные ожоги. H2SO4 - это сильная двухосновная кислота, образующая два ряда солей – гидросульфаты и сульфаты. Разбавленная H2SO4 проявляет все типичные свойства кислот – неокислителей. Концентрированная H2SO4 является очень сильным окислителем, при нагревании она растворяет почти все металлы (кроме драгоценных), сама же восстанавливается до SО2, S и H2S в зависимости от активности металла (следует помнить, что в данном случае окислителем является оксид серы (У1). С малоактивными металлами:
2H2SO4 конц+Cu0=CuSO4+S02+2H2O
2 Cu - 2e = Cu 2+ SO42- + 2 Cu + 4H+= SO2 + 2H2O + Cu 2+ . С металлами средней активности: 4H2SO4конц+3Zn0=3ZnSO4+S+4H2O
3 Zn - 2e = Zn 2+ SO42- + 3 Zn + 4H+= S + 4H2O + 3 Zn 2+ .
С очень активными металлами: 5H2SO4конц+4Mg=4MgSO4+H2S+4H2O
4 Mg - 2e = Mg 2+ SO42- + 4 Mg + 10H+= H2S + 4H2O +Mg 2+ .
Концентрированная H2SO4 взаимодействует с неметаллами (C,S, Р и др.): 2 P+ 5H2SO4конц =2H3PO4+ 5SO2+2H2O
2 P - 5e + 4 H2O = H3 PO4 + 5H+ 5SO42-+ 20H+ + 2 P + 4 H2O = 5SO2 + 10H2O +2H3 PO4 + 10H+ Kонцентрированная H2SO4 обугливает органические вещества: C12H22O11=12C+11H2O, При насыщении, серной кислоты 45-процентным избыточным количеством SО3 образуемся пиросерная кислота H2S2O7.
При кипячении раствора сульфата натрия с порошкообразной серой образуется соль тиосерной кислоты: Na2SO3+S =Na2S2O3. В тиосульфате натрия сера имеет различные степени окисления, это хорошо можно проиллюстрировать с помощью графической формулы
Тиосерная кислота неустойчива из-за внутримолекулярного окислительно-восста-новительного процесса:
Поэтому при окислении тиосульфатов выделятся свободная сера и оксид серы (IV): Na2S2O3+2HCl=H2S2O3+NaCl H2S2O3=H2O+SO2 Соли тиосерной кислоты - тиосульфаты - вполне устойчивы, бесцветны и хорошо растворимы в воде. Наиболее практическое значение имеет тиосульфат натрия (гипосульфит) Na2S2O3. Восстановительные свойства тиосульфатов обусловлены присутствием атомов серы в степени окисления –2. Хлор окисляет тиосульфат до свободной серы:
Na2S2O3+Cl2+H2O=Na2SO4+2HCl+S
1 (SO3S)2—2e+H2O=S+SO42-+2H+________ Cl2+(SO3S)2-+H2O=2Cl-+S+ SO 42-+2H+. Реакция тиосульфата с иодом, сравнительно слабым окислителем, протекает с образованием соли тетратионовой кислоты - тетратионат натрия Na2S4O6:
1 J2+2e=2J- 1 (S2O3)2—2e=(S4O6)2-_________ J2+(S2O3)2-=2J-+(S4O6)2-. Эта реакция используется в аналитической химии в одном из методов тит-риметрического анализа - иодометрии. Лекция 3 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|
 2 MnO-4+3e+2H2O=MnO2+4OH-
2 MnO-4+3e+2H2O=MnO2+4OH- Na2S3
Na2S3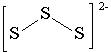
 SO2;
SO2; SO2 − бесцветный газ, обладающий сильным удушающим действием, легко сжижается, имеет т. пл. - 75 °С; т. кип. - 10 °С. Угол связи в молекуле SO2 составляет 119,5 °, поэтому показать строение молекулы можно следующим образом:
SO2 − бесцветный газ, обладающий сильным удушающим действием, легко сжижается, имеет т. пл. - 75 °С; т. кип. - 10 °С. Угол связи в молекуле SO2 составляет 119,5 °, поэтому показать строение молекулы можно следующим образом: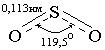
 H2SO3; H2SO3
H2SO3; H2SO3 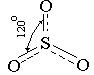
 2SO2+O2.
2SO2+O2. 1 SO42-+ 2e+ 4H+= SO2 + 2H2O
1 SO42-+ 2e+ 4H+= SO2 + 2H2O 1 SO42-+ 8e+ 10H+ = H2S + 4H2O
1 SO42-+ 8e+ 10H+ = H2S + 4H2O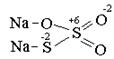 .
. .
. +S
+S 
 2Na2S2O6+J2=2NaJ+Na2S4O6
2Na2S2O6+J2=2NaJ+Na2S4O6