
|
|
Кислородные соединения азотаОксид азота (I) N2O − бесцветный газ со слабым, приятным запахом и сладким вкусом. Вдыхание его вызывает состояние опьянения, потерю болевых ощущений, поэтому он нашел применение в медицине в качестве анестезирующего средства. Этот оксид азота можно получить разложением нитрата аммония при 250 0С: NH4NO3=N2O+ H2O. Oксид растворяется в воде, но устойчивых соединений не образует. При комнатной температуре устойчив, при нагревании выше 500 °С разлагается: 2N2O=t2N2+O2. Оксид азота (I) - безразличный оксид. Структурную формулу этого оксида можно изобразить следующим образом:
В соответствии с sр -гибридизацией валентных орбиталей N+ молекула имеет линейное строение, Можно также рассматривать структурную формулу оксида с точки зрения образования центральным атомом азота донорно-акцепторной связи:
Центральный атом представляет для связи два неподеленных электрона. Эта связь изображается стрелкой, направленной от донора к акцептору: O=N=N Оксид азота (П)представляет собой бесцветный газ без запаха, мало-растворимый в воде, на воздухе он легко окисляется 2NO+O2=NO2. Это эндотермическое соединение DG298= 90 ( кДж/моль). Оксид азота (II) относится к безразличным оксидам. В природе NO образуется при грозовых разрядах по цепной реакции: N2+O2=2NO2, DG=-35,7 кДж В промышленности получают каталитическим окислением аммиака в при-сутствии платины и оксидов железа и хрома 4NH3+5O2=4NO+6H2O. В лаборатории NO образуется при действии на медь разбавленной азотной кислоты 3Cu+8HNO3 разб.= 3Cu(NO3)2+2NO+4H2O Молекула NO парамагнитная. Согласно методу молекулярных орбиталей, один из электронов в молекуле находится на
Оксид азота (П) легко окисляется галогенами, образуя гадогениды нитрозила: 2NO+Cl2=NOCl. Молекула NO выступает как лиганд в разнообразных комплексах, называе- мых нитрозильными. Оксид азота (III), азотистая кислота и ее соли - нитриты Оксид азота (III) - N2O3 существует только в твердом состоянии при низких температурах. В виде жидкости и пара в значительной степени диссоциирован: N2O3 Его получают охлаждением смеси NO2 и NO. Согласно данным, полученным с помощью инфракрасной спектроскопии, полагают, что кристаллы N2O3 состоят из стабильной и нестабильной модификации: O N N O = N –N O O O . O Азотистая кислота получается при взаимодействии нитрита натрия с разбав-ленной серной кислотой: NaNO2+H2SO4=NaHSO4+HNO3. Это слабая кислота (К = 5.10-4), существует только в очень разбавленных растворах, а потому сравнительно легко разлагается: 2HNO2=N2O3+H2O. Для HNO2 вероятны две таутомерные структуры
Нитрит-ион имеет угловую форму
Нитриты − соли азотистой кислоты − устойчивы. Наибольшее практическое значение имеет нитрит натрия, используемый в производстве красителей и лабораторной практике. Нитриты могут быть получены пропусканием эк-вимолярной смеси оксидов азота (II) и (IV) в раствор щелочи NO+NO2+2NaOH=2NaNO2+H2O. Производные азота (III) проявляют восстановительные и окислительные свойства: 2NaNO2+2KJ+2H2SO4=J2+2NO+K2SO4+Na2SO4+2H2O
1 2J- -2e= J2 2 NO-2+2H++ 2J- =2 NO+2H2O + J2 5NaNO2+2KMnO4+3H2SO4=2MnSO4+5NaNO3+K2SO4+3H2O 5 NO2ˉ+H2O-2e=NO3ˉ+2H+ 2 MnO4ˉ +8H+ + 5е = Mn2+ +4H2O 5NO2ˉ+5H2O+ 2MnO4ˉ +16H+=5NO3ˉ+10H++2Mn2++8H2O Кроме того, они склонны к реакциям диспропорционирования: 3HNO2=HNO3+NO2+H2O. Оксид азота IV Диоксид азота NO2 - газ бурового цвета, токсичен. Его молекула – парамагнитна, имеет угловую форму NO2 N2O4 Бурый Бесцветный парамагнитен диамагнитен Жидкий и твердый диоксид азота бесцветен, состоит из молекул N2O4. Молекула плоская, диамагнитная. Диоксид азота образуется при окислении NО , также при разложении нитратов тяжелых металлов: 2Рb(NO3)2=2РbO+4NO2+O2. В лаборатории NO2 получают при действии концентрированной азотной кислоты на медь Cu+4HNO3конц=Cu(NO3)2+2NO2+2H2O Оксид хорошо растворяется в воде 2NO2+H2O=HNO2+HNO3 HNO2+NO2=HNO3+NO 3NO2+H2O=2HNO3+NO. Растворение NO2 в воде при избытке кислорода под давлением идет по уравнению 2NO2+2H2O+O2=4HNO3. При растворения в щелочи также образуется смесь нитратов и нитритов :
1NO2 + Н2О – е = NO3ˉ + 2Н+ 1 NO2 + е = NO2ˉ NO2 + H2O + NO2 = NO3ˉ + 2Н+ +NO2ˉ 
Не нашли, что искали? Воспользуйтесь поиском по сайту: ©2015 - 2026 stydopedia.ru Все материалы защищены законодательством РФ.
|

 =0,17 Д.
=0,17 Д.
 рразр -орбитали, порядок связи составляет 2,5. Структурную формулу можно изобразить следующим образом:
рразр -орбитали, порядок связи составляет 2,5. Структурную формулу можно изобразить следующим образом: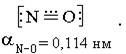
 NO2+NO; DG0298=1,8 кДж.
NO2+NO; DG0298=1,8 кДж.
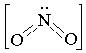
 2 NO-2+2H++1e=NO+H2O
2 NO-2+2H++1e=NO+H2O 2NO2+KOH=KNO3+KNO2+H2O
2NO2+KOH=KNO3+KNO2+H2O